题目内容
7.某市大气质量监测站对市区出现雾霾时的大气监测发现:首先要污染物为PM2.5,并对其进行分析.(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:
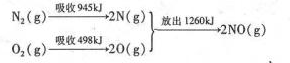
①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
分析 (1)根据溶液中电荷守恒计算出氢离子浓度,再计算出其pH;
(2)根据(1)的计算结果可知,该大气的污染物溶于水容易形成酸雨;
(3)①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②该反应为吸热反应,根据温度对化学平衡的影响分析;
③根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答;
(4)原电池中负极失去电子被氧化,根据反应2NO+O2=2NO2中化合价变化判断负极反应、写出负极电极反应式;根据电子守恒计算出通过传感器的NO的流量.
解答 解:(1)溶液中电荷守恒:2c(Ca2+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)+c(OH-),则c(H+)-c(OH-)=2c(SO42-)+c(NO3-)+c(Cl-)-2c(Ca2+)-c(NH4+)-c(Na+)=(2×4×10-6+3×10-5+2×10-6-2×2×10-6-6×10-6-2×10-5)mol/L=1×10-5mol/L,该溶液的pH=5,
故答案为:5;
(2)结合(1)可知,该空气的污染物溶于水,溶液的pH=5<5.6,所以降雨后会形成酸雨,故答案为:形成酸雨;
(3)①该反应中的反应热=反应物的键能和-生成物的键能和=(946+498)kJ/mol-2×630kJ/mol=+184kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1;
②该反应为吸热反应,汽车启动后,气缸温度越高,平衡向着正向移动,则单位时间内生成NO的量越大,故其排放量越大,
故答案为:正反应为吸热反应,升高温度,平衡向着正向移动;
③将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,在下列四种物质:a.NH3b.CO2c.SO2d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇、二氧化硫和NH3,而二氧化硫为大气污染物,所以只有ad正确,
故答案为:还原剂;ad;
(4)以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,负极失去电子被氧化,则负极NO失去电子生成二氧化氮,电极反应式为:NO+O2--2e-=NO2;若传感器检测的电子流量为1×10-3mol/s,根据电子守恒,则每秒消耗的NO的物质的量为:$\frac{0.001mol}{2}$=5×10-4mol,所以通过传感器的NO的流量为30g/mol×5×10-4mol/s=0.015g/s=15mg/s,
故答案为:NO+O2--2e-=NO2;15.
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握原电池原理、热化学方程式的书写原则、影响化学平衡的因素等知识.

| A. | 丁烷 | B. | 异丁烷 | C. | CH3CH=CHCH3 | D. | CH2=CHCH2CH3 |
| A. | 可通过热还原法制备金属铝和铁 | |
| B. | 工业制硫酸产生的废气需用石灰水吸收 | |
| C. | 淀粉、植物油、蛋白酶均为高分子化合物 | |
| D. | 水晶、玛瑙、光导纤维、陶瓷的主要成分都是二氧化硅 |

| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 在周期表主族元素的最外层电子数等于其主族序数 | |
| D. | 元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素 |
 .
.
 、
、 (写2种).
(写2种).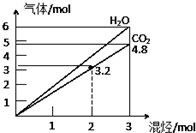 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )