题目内容
12.下表中实线是元素周期表的部分边界,其中上边界并未用实线标出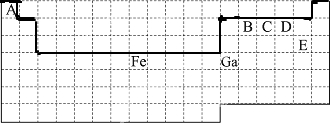 .
.
根据信息回答下列问题.
(1)周期表中基态Ga原子的最外层电子排布式为4s24p1.
(2)Fe元素位于周期表的d区e原子的最外层电子数为2;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO分子互为等电子体的分子和离子分别为N2和CN-(填化学式).
(3)在CH4、CO、CH2=CH2中,碳原子采取sp2杂化的分子有CH2=CH2,碳原子采取sp3杂化的分子有CH4.
(4)根据VSEPR理论预测ED${\;}_{4}^{-}$离子的空间构型为正四面体.B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为
 、
、 (写2种).
(写2种).
分析 上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图: ;(1)、主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理(先排能量低的后排能量高的),4s的能量小于4p的能量,4s能级最多排两个电子,4p能级最多排6个电子;
;(1)、主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理(先排能量低的后排能量高的),4s的能量小于4p的能量,4s能级最多排两个电子,4p能级最多排6个电子;
(2)、元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,所以根据能量最低原理先排4s电子后排3d电子,根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体.CO分子含两个原子,且组成该物质的元素一个是6号一个是8号,找它的等电子体时,如果是分子,就把两种元素的原子序数一个增大1一个减小1,如果是离子,其中一种元素不变,另一种原子序数增大(或减小),带正电荷(或负电荷);
(3)、判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,如:如果是直线型,采取的就是SP杂化;
(4)、分子空间构型的判断
价层电子对数=σ键电子对数+中心原子上的孤电子对数
σ键电子对数=σ键个数=中心原子结合的原子个数
中心原子上的孤电子对数=1/2(a-xb)
说明:对于分子,a为中心原子的价电子数
对于阳离子,a为中心原子的价电子数-离子所带的电荷数如:NH4+
对于阴离子,a为中心原子的价电子数+离子所带的电荷数如:CO3-
x为配位原子个数;b为配位原子最多能接受的电子数
如果价层电子对=2,VSEPR模型为直线型
如果价层电子对=3,VSEPR模型为平面三角形
如果价层电子对=4,VSEPR模型为四面体,由此分析.
解答 解:上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图: ,故答案为:
,故答案为: ;
;
(1)、元素周期表每一横行是一个周期,一共有18个纵行,从左向右,1、2和13至17七个纵行是主族,且第一纵行开始分别为第IA族、第IIA族,第IIIA族、第IVA族,V第A族,V第IA族,第VIIA族,Ga是第四横行第十一纵行的元素,所以是第四周期第IIIA族的元素,主族元素的族序数=其最外层电子数=其价电子数,所以Ga最外层有3个电子,最外层电子在排列时,遵循能量最低原理(先排能量低的后排能量高的),4s的能量小于4p的能量,4s能级最多排两个电子,故答案为:4s24p1.
(2)、元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,
根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,最外层有2个电子,根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.
CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2.
如果是阳离子离子,原子序数之和减去所带电荷数值,如果是阴离子,原子序数之和加上所带电荷数值,等于CO的原子序数之和即可所以是CN-..
故答案为:d区;2;N2、CN-.
(3)、判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式.价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子上的孤电子对数=1/2(a-xb),说明:对于分子,a为中心原子的价电子数,x为配位原子个数,b为配位原子最多能接受的电子数
.在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化;CH2=CH2中,价层电子对数=σ键电子对数(3)+中心原子上的孤电子对数(0),所以碳原子采取sp2杂化.
故答案为:CH2=CH2、CH4;
(4)、根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=1/2(a-xb),说明:x为配位原子个数,b为配位原子最多能接受的电子数,对于阴离子,a为中心原子的价电子数+离子所带的电荷数,中心原子上的孤电子对数=1/2(a-xb)=1/2(8-4*2)=0,所以价层电子对数=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型.
根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,分子中每个原子最外层都达到8电子稳定结构的判断公式是:化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构.否则就没有达到8电子稳定结构.对于C元素,8-原子最外层电子数(4)=化合价的绝对值(4)
对于O元素,8-原子最外层电子数(6)=化合价的绝对值(2)
对于N元素,8-原子最外层电子数(5)=化合价的绝对值(3)
对于Cl元素,8-原子最外层电子数(7)=化合价的绝对值(1)
所以两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2 CCl4,CO2 的电子式为: ; CCl4电子式为
; CCl4电子式为
故答案为:正四面体、 、
、
点评 本题考查基态原子或离子的核外电子排布或最外层电子排布、分子中原子采取的杂化方式、对于元素周期表,学习时要记住它的周期、族的划分,要熟记前36号元素,五区的划分、边界、划分依据等都要掌握,考查方式较多,在学习中要灵活掌握根据VSEPR理论预测分子或离子的空间构型是学习的重点,也是近几年高考的热点.

| A. | C2H5OH | B. | H2O | C. | CH3COOH | D. | C6H12 |
| A. | 1<n<2 | B. | 1<n<5 | C. | 2<n<4 | D. | 2<n<5 |
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及浓度如下表:
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
(2)该地区若有降雨则可大大缓解雾霾天气,但也会带来另一种环境问题:形成酸雨.
(3)环境治理要从根源一着手,减少SO2、NO2等气体的排放是重要措施.汽车发动机工作时气缸中会引发N2和O2的反应,其能时变化示意图如下:
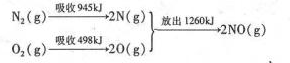
①写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
②汽车启动后,气缸温度越高,单位时间内NO的排放量越大,其原因是:正反应为吸热反应,升高温度,平衡向着正向移动.
③将NO2变成无害的N2要找到合适的物质G与适当的反应条件,G应为还原剂(填“还原剂”或“氧化剂”).下式中X必须为无污染的物质,化学计量数n可为0.NO2+G→N2+H2O+nX(未配平的反应式)
下列化合物中满足上述反反应式式中的G是ad(填字母代号).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)利用电化学传感器能够准确、快速地测定NO2的含量.一种以ZrO2为固体电解质(传递O2-),总反应为:2NO+O2=2NO2,则其负极的电极反应为NO+O2--2e-=NO2.若传感器检测的电子流量为1×10-3mol/s,则通过传感器的NO的流量为15mg/s.
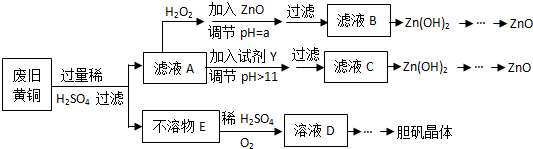
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a的范围是3.0≤a<5.9.
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(3)滤液A中加入H2O2反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后沉淀溶解.
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
| A. | 乙烯通入浓盐酸中 | B. | 乙烯与氯化氢加成反应 | ||
| C. | 乙烷与氯气在光照下反应 | D. | 乙烷通入氯水中 |
| A. | SO2与Si02 | B. | CCl4与KCl | C. | NaCl与HCl | D. | HNO3与H20 |