题目内容
(18分)氨、氯气和溴是中学化学实验中的常见试剂:
(1)实验室利用反应:2NH3+3CuO N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。
N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。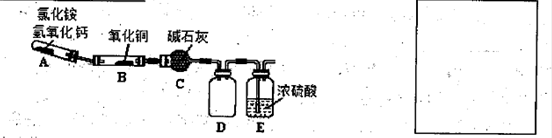
上述装置设计尚存在缺陷,应在 (填上述仪器字母序号)之间再加一个装置,请画出该装置(注明所需试剂)。
(2)实验室用Cl2从盐湖苦卤(富含K+、Ca2+、Mg2+、Br-、SO 、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:
、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下: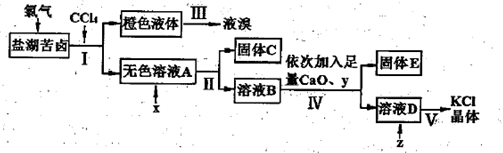
①步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为 。
②加入试剂x的目的是 ;步骤Ⅳ中试剂y的化学式为 ;
③步骤v中蒸发溶液D时需要的仪器除酒精灯、三脚架外还需 。
(3)Br2和FeCl3的稀溶液均呈黄色。将少量稀溴水滴入稀FeCl2溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,则二者未发生化学反应。该实验设计不正确,错误在于____ 。设计合理实验检验溴水和FeCl2溶液是否发生化学反应(简要说明实验步骤、现象和结论) 。
(18分)
(1)A(1分)吸收反应产生的水(1分)AB(2分) (2分,其它合理答案也得分)
(2分,其它合理答案也得分)
(2)①先打开分液漏斗上口玻璃塞,或使塞上凹槽(或小孔)对准漏斗上的小孔,再拧开分液漏斗下口活塞,使下层液体慢慢沿烧杯壁留下,当下层液体流完后迅速关闭下口活塞,将无色液体A从上口倒出。(2分)
②除去SO42?(2分) K2CO3(2分)
③蒸发皿、玻璃棒(2分)
(3)因为Br2和Fe3+都能把I?氧化成I2,使溶液变蓝,无法得出结论;(2分)取少量黄色混合溶液,滴加KSCN溶液,溶液变为血红色,说明二者发生化学反应,反之则不反应。(2分)
解析试题分析:(1)先点燃A处的酒精灯,产生的氨气把装置内的空气排出,防止出现误差;碱石灰具有吸水性,吸收反应产生的水;因为氯化铵和氢氧化钙反应制取的氨气中含有水分,所以AB之间增加干燥NH3的装置,如盛有碱石灰的干燥管。
(2)①为了使液体顺利滴下,应先打开分液漏斗上口玻璃塞,或使塞上凹槽(或小孔)对准漏斗上的小孔,再拧开分液漏斗下口活塞,使下层液体慢慢沿烧杯壁留下,当下层液体流完后迅速关闭下口活塞,将无色液体A从上口倒出。
②杂质SO42?用BaCl2溶液去除,CaO与水反应生成Ca(OH)2,除去Mg2+,再用K2CO3除去Ca2+和过量的BaCl2,所以试剂x为BaCl2溶液,作用是除去SO42?;试剂y为K2CO3。
③步骤v为蒸发结晶,蒸发溶液需要的仪器除酒精灯、三脚架外还需蒸发皿、玻璃棒。
(3)因为Br2和Fe3+都具有氧化性,都能把I?氧化成I2,使溶液变蓝,所以无法得出结论;若溴水和FeCl2溶液反应,则生成Fe3+,加KSCN溶液可验证,所以实验方法为:取少量黄色混合溶液,滴加KSCN溶液,溶液变为血红色,说明二者发生化学反应,反之则不反应。
考点:本题考查实验基本仪器与基本操作、实验方案的设计与分析、化学流程的分析。

 阅读快车系列答案
阅读快车系列答案氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。若某氮化铝中含有碳或氧化铝中的一种,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
(1)实验有关操作为:a.往烧瓶中放入适量的AlN样品:b.从分液漏斗往烧瓶中加入过量的浓NaOH溶液:c.检验装置的气密性;d.测定收集到水的体积。
正确的操作顺序为: 。
(2)本实验中(图Ⅰ)检查装置气密性的方法是: 。
(3)广口瓶中的试剂X可选用 (填选项前的标号)。
| A.汽油 | B.酒精 | C.植物油 | D.CCl4 |
(5)若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为: 。
(6)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸增加的质量来确定样品中AlN的质量分数。你认为是否可行? (填“可行”或“不可行”),原因是 。
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度
(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a. 实验1和2探究 ; b. 实验1和3探究反应物浓度对该反应速率的影响; c. 实验1和4探究催化剂对该反应速率的影响。 | |
| 体积 (mL) | 浓度 (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为 。
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题: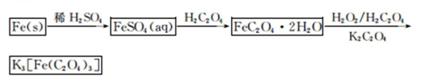
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 (填序号)。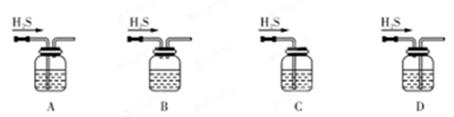
(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是 。
(4)C2O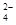 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 。
②下列滴定操作中使滴定结果偏高的是 (填序号)。
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
化学是一门以实验为基础的科学。
(1)下列叙述中正确的是______(填序号)。
| A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水 |
| B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘 |
| C.洁净的铁钉在食盐水中浸泡一段时间,铁钉上有气泡,说明铁发生了析氢腐蚀 |
| D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体 |
(2)用铜片与稀硝酸反应制取NO气体,如图装置中适合的是______(填序号);装置B中的试剂最好是______,该装置的作用是______________________。


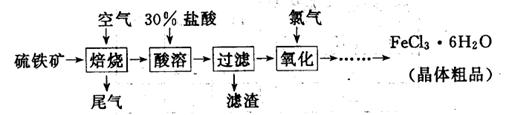
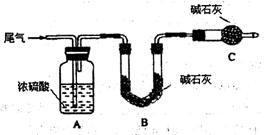
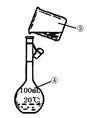
 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .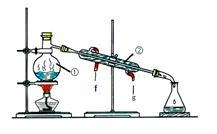
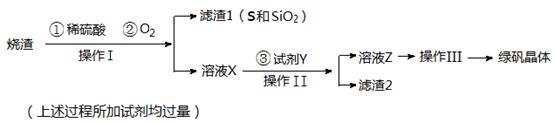 试回答:
试回答: