题目内容
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。若某氮化铝中含有碳或氧化铝中的一种,现用图I中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
(1)实验有关操作为:a.往烧瓶中放入适量的AlN样品:b.从分液漏斗往烧瓶中加入过量的浓NaOH溶液:c.检验装置的气密性;d.测定收集到水的体积。
正确的操作顺序为: 。
(2)本实验中(图Ⅰ)检查装置气密性的方法是: 。
(3)广口瓶中的试剂X可选用 (填选项前的标号)。
| A.汽油 | B.酒精 | C.植物油 | D.CCl4 |
(5)若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为: 。
(6)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸增加的质量来确定样品中AlN的质量分数。你认为是否可行? (填“可行”或“不可行”),原因是 。
(1)c、a、b、d
(2)关闭分液漏斗活塞,微热圆底烧瓶,广口瓶中右侧导管水柱上升,静置片刻,水柱并不回落
(3)AC
(4)碳
(5) 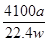 %
%
(6)不可行 氨气极易被稀硫酸吸收,发生倒吸现象。
解析

练习册系列答案
相关题目
下列说法中正确的是
| A.在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变且晶体质量变小 |
| B.检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C.纸上层析法通常以滤纸作为惰性支持物,滤纸纤维上的羟基所吸附的水作为流动相 |
| D.在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的水溶液,再与相同大小的金属钠反应,来判断两者羟基上氢的活性 |
下列仪器中具有①溶解固体,②配制溶液,③加热较多量液体三种用途的是( )
| A.集气瓶 | B.量筒 |
| C.试管 | D.烧杯 |
下列做法不正确的是( )
| A.将浓硝酸保存在无色玻璃瓶中 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.加热后的试管不能立即用冷水冲洗,防止骤冷炸裂 |
| D.进行蒸发时蒸发皿放在铁圈上直接加热,并用坩埚钳夹取 |
下列操作或实验现象预测正确的是
| A.实验I:振荡后静置,下层溶液颜色变深 |
| B.实验Ⅱ :烧杯中先出现白色沉淀,后溶解 |
| C.实验III:放置一段时间后,小试管内有晶体析出 |
| D.实验Ⅳ:为确认CuSO4生成,向①中加水,观察颜色 |




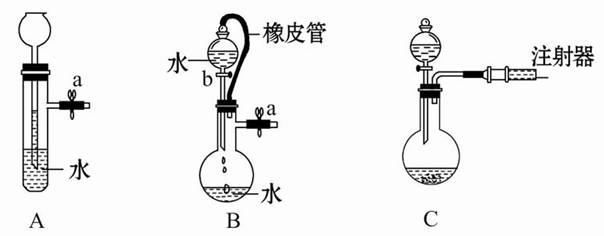
 N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。
N2+3Cu+3H2O中反应物CuO和生成物H2O的质量可以测定铜的近似相对原子质量,实验装置(加热及夹持装置未画出)如下。实验开始时,应先点燃 (填‘‘A”‘‘B”)处酒精灯;c中碱石灰的作用为 。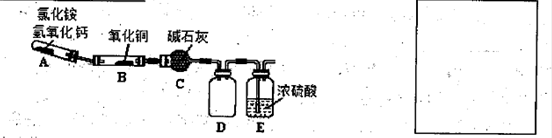
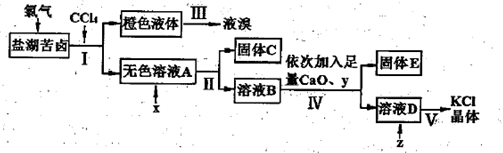
 、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下:
、Cl-等)中提取较纯净的氯化钾晶体及液溴,流程如下: