题目内容
【题目】一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:

①S(单斜)+O2(g) =SO2(g) ΔH=-297.16 kJ/mol
②S(正交)+O2(g) = SO2(g) ΔH=-296.83 kJ/mol
下列说法错误的是( )
A.S(g)+O2(g)=SO2(g) ΔH=-Q3 kJ/mol Q3> 297.16
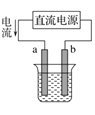
B.单斜硫转变为正交硫的能量变化可用如图表示
C.常温下单斜硫比正交硫稳定
D.单斜硫转化为正交硫的反应是放热反应
【答案】BC
【解析】
A. 硫气体变化为固体需要放出热量,又S(单斜)+O2(g)═SO2(g)△H=-297.16kJ/mol,所以S(g)+O2(g)═SO2(g)△H=-Q3kJ/mol Q3>297.16,故A正确;
B. ①S(单斜)+O2(g)═SO2(g)△H=-297.16kJ/mol
②S(正交)+O2(g)═SO2(g)△H=-296.83kJ/mol
依据盖斯定律①-②得到S(单斜)=S(正交)△H=-0.33kJ/mol,单斜硫能量高于正交硫,故B错误;
C. 单斜硫能量高于正交硫,单斜硫稳定性小于正交硫,故C错误;
D. 依据B分析,S(单斜)=S(正交)△H=-0.33KJ/mol,反应是放热反应,故D正确;
故选:BC。

【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
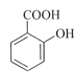 +(CH3CO)2O
+(CH3CO)2O![]()
 +CH3COOH
+CH3COOH
水杨酸 酸酐 乙酰水杨酸
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~74 | 135~138 |
相对密度/(g/cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中最好采用__________加热(填标号)。
A. 酒精灯 B.热水浴 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号)。

(3)①中需使用冷水,目的是_________________________。
(4)②中的主要化学反应方程式是:____________________。
(5)④采用的纯化方法为____________。
(6)本实验的产率为_________%。