题目内容
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)①对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
②若用甲烷作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g) △H < 0
CH3OCH3(g) + 3H2O(g) △H < 0
①对于该反应下列说法正确的是( )
②将6 molH2和2 mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率为
(1)①对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
②若用甲烷作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g) △H < 0
CH3OCH3(g) + 3H2O(g) △H < 0①对于该反应下列说法正确的是( )
| A.若温度升高,则反应的平衡常数K将增大” |
| B.一定条件下增加H2的浓度可以提高反应速率 |
| C.加入催化剂可提高CO2的转化率 |
| D.恒温恒容条件下若压强保持不变,可认为反应到达平衡状态 |
(1)①CH4(g)+2NO2(g)=N2(g)+CO2(g) +2H2O(g) △H=-867 kJ·mol-1
②CH4 -8e- +10 OH-=CO32- +7H2O
(2)①BD ② CO2的转化率为80%
②CH4 -8e- +10 OH-=CO32- +7H2O
(2)①BD ② CO2的转化率为80%
试题分析:(1)①将第一个式子与第二个式子相叠加,就的到CH4(g)将NO2(g)还原为N2(g)等的热化学方程式,即CH4(g)+2NO2(g)=N2(g)+CO2(g) +2H2O(g) △H=-867 kJ·mol-1。
(2)①A.反应为吸热反应,升高温度反应逆向移动,K将减小,故错;
B.增大其它的浓度,反应速率加快,故正确;
C.催化剂不影响化学平衡的移动,故错;
D.反应前后的气体的总物质的量是不相等的,故正确。
点评:本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较麻烦。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
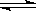 CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。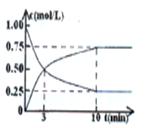
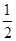 O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol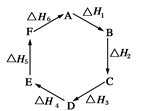
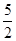 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1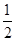 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1