题目内容
已知 1mol白磷转化为红磷时放出 18.39 kJ的热量。在下列两个反应中:
4P(白、s)+ 5O2(g)=2P2O5(s);ΔH =" -" a kJ/mol(a > 0)
4P(红、s)+ 5O2(g)=2P2O5(s);ΔH =" -" b kJ/mol(b> 0),则a 和 b 的关系为
4P(白、s)+ 5O2(g)=2P2O5(s);ΔH =" -" a kJ/mol(a > 0)
4P(红、s)+ 5O2(g)=2P2O5(s);ΔH =" -" b kJ/mol(b> 0),则a 和 b 的关系为
| A.a < b | B.a = b |
| C.a > b | D.无法确定 |
C
试题分析:根据盖斯定律可知,前者减去后者,即得到4P(白、s)=4P(红、s),则该反应的反应热△H=-(a-b)kJ/mol=-18.39 kJ/mol×4,所以a>b,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是利用好盖斯定律,有利于培养学生的逻辑思维能力,提高学生的答题效率。

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
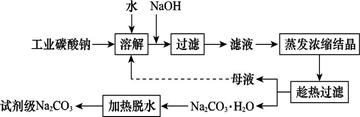

 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)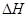 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1

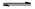 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1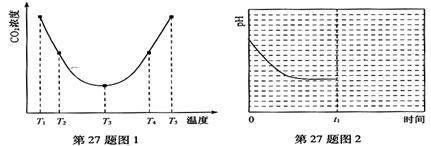

 CH3OCH3(g) + 3H2O(g) △H < 0
CH3OCH3(g) + 3H2O(g) △H < 0