��Ŀ����
����Ŀ������I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��
5CO��g��+I2O5��s��5CO2��g��+I2��s������H1
��1����֪��2CO��g��+O2��g��2CO2��g������H2
2I2��s��+5O2��g��2I2O5��s������H3
���H1=____________________���ú���H2�͡�H3�Ĵ���ʽ��ʾ����
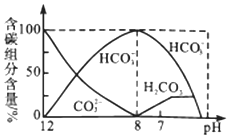
��2����ͬ�¶��£���װ������I2O5�����1L�����ܱ�������ͨ��1molCO�����CO2��Ũ��c��CO2����ʱ��t�仯������ͼ����ش�

�ٴӷ�Ӧ��ʼ��a��ʱ�ķ�Ӧ����Ϊv��CO��=______________��b��ʱ��ѧƽ�ⳣ��Kb=______��
��d��ʱ���¶Ȳ��䣬�����������ѹ����ԭ����һ�룬����ͼ�в��仭��CO2��������ı仯����_________��
������˵����ȷ����_____��������ĸ��ţ�
A�������������ܶȲ��䣬������Ӧ�ﵽƽ��״̬
B�������¶��£�c��ʱ��ϵ�л�������ƽ����Է����������
C������I2O5��Ͷ�������������CO��ת����
D��b���d��Ļ�ѧƽ�ⳣ����Kb��Kd��
���𰸡�2.5��H2��0.5��H3 0.6molL��1min��1 1024  AB
AB
��������
��1�����ø�˹���ɼ��㣻
��2����������ʽ���㣻
�ڸ���5CO��g��+I2O5��s��5CO2��g��+I2��s����֪����ӦΪ�����������ķ�Ӧ�����ѹǿ��ƽ����Ӱ�죻
��A.�����ܶ�=![]() �жϣ�
�жϣ�
B.���������¶��£�C������������������жϣ�
C.���ݹ���Ķ��ٶ�ƽ����Ӱ���жϣ�
D.����k=![]() �жϣ�
�жϣ�
��1�����ݸ�˹���ɣ���2CO��g��+O2��g��2CO2��g������H2
��2I2��s��+5O2��g��2I2O5��s������H3 �١�![]() -�ڡ�
-�ڡ�![]() �á�H1= 2.5��H2��0.5��H3
�á�H1= 2.5��H2��0.5��H3
�𰸣�2.5��H2��0.5��H3��
��2��5CO��g��+I2O5��s��5CO2��g��+I2��s����Ӧ����������������ʵ������䣬��˷�Ӧ��������������ʵ���ʼ��1mol��������������������������ʵ����������ɼ��������������ʵ�����
��a�㣺
5CO��g��+I2O5��s��5CO2��g��+I2��s��
c������1 0
��c 0.3 0.3
v��CO��=![]() =
=![]() =0.6molL��1min��1��
=0.6molL��1min��1��
b�㣺5CO��g��+I2O5��s��5CO2��g��+I2��s��
c������ 1 0
��c 0.8 0.8
c��ƽ�� 0.2 0.8
Kb=![]() =1024��
=1024��
�𰸣�0.6molL��1min��1��1024��
��5CO��g��+I2O5��s��5CO2��g��+I2��s����Ӧ����������������ʵ������䣬d��ʱ���¶Ȳ��䣬�����������ѹ����ԭ����һ�룬ƽ�ⲻ�ƶ���CO2������������䣻
�𰸣�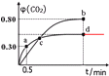 ��
��
��A.�ܶ�=![]() ������Ӧ���й����У������������������������ʵ������䣬���ܶ��������ܶȲ���ʱ����Ӧ�ﵽ��ƽ�⣬��A��ȷ��
������Ӧ���й����У������������������������ʵ������䣬���ܶ��������ܶȲ���ʱ����Ӧ�ﵽ��ƽ�⣬��A��ȷ��
B.c��ʱ�������¶��£�������İٷֺ�����ȣ������ϵ�л�������ƽ����Է���������ȣ���B��ȷ��
C. I2O5Ϊ���壬����I2O5��Ͷ������ƽ�ⲻ�ƶ�����C����
D. k=![]() ����b���d��Ļ�ѧƽ�ⳣ����Kb>Kd����D����
����b���d��Ļ�ѧƽ�ⳣ����Kb>Kd����D����
�𰸣�AB��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�����Ŀ��ijͬѧ��ͬ����Ԫ�����ʵݱ����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ���������±���
ʵ�鷽�� | ʵ������ |
����ɰֽ�����þ�����ˮ��Ӧ������ӦҺ�еμӷ�̪ | A������ˮ�棬�۳�С����ˮ���������ƶ�����֮��ʧ����Һ��ɺ�ɫ |
�������Ƶ�H2S������Һ�еμ����Ƶ���ˮ | B�������������壬���ڿ�����ȼ�գ���Һ���dz��ɫ |
��������з�̪��Һ����ˮ��Ӧ | C����Ӧ��ʮ��ǿ�ң���������������ڿ�����ȼ�� |
��þ����2mol��L-1�����ᷴӦ | D�����ҷ�Ӧ����������������ڿ�����ȼ�� |
��������2mol��L-1�����ᷴӦ | E�����ɰ�ɫ��״�������̶�������ʧ |
�����Ȼ�����Һ�еμ�����������Һ | F�����ɵ���ɫ���� |
���������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ�______________________________________��
��2��ʵ����Ʒ������___________________�ȣ�ҩƷ________________________�ȡ�
��3��ʵ�����ݣ���*��д�����Ϣ���е���ţ�
ʵ�鷽��* | ʵ������* | �йػ�ѧ����ʽ |
_______________________________
��4��ʵ����ۣ�______________________________________��
��5����ӽṹ�����ϼ�˵�������������۵�ԭ��___________________��
��6�����㲹��һ��ʵ�鷽���������У���֤������������������Ԫ�ص����ʵݱ����_____________________________________��
����Ŀ����ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���̣�
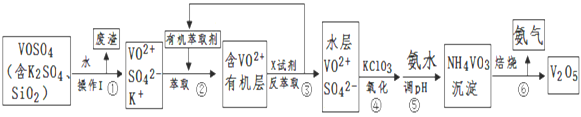
��1����������÷����ijɷ���____________��д��ѧʽ��������I������__________��
��2����������۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������R2(SO4)n (ˮ��)+ 2nHA���л��㣩![]() 2RAn���л��㣩 + nH2SO4 (ˮ��)
2RAn���л��㣩 + nH2SO4 (ˮ��)
������ȡʱ��������������ԭ����_____________________________��
����X�Լ�Ϊ��д��ѧʽ��______________________________________��
��3���ܵ����ӷ���ʽΪ ___________________________________________��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ____________������������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)< _____________��(��֪��25��ʱ��Ksp[Fe(OH)3]=2.6��10-39)
��5���ù��������У�����ѭ�����õ�������__________��_______________��