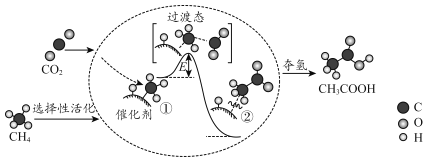
题目内容
【题目】回答下列问题:
(1)某同学测量强酸和强碱的中和热,将50.0 mL 0.10 mol·L-1 H2SO4溶液与50.0 mL 0.22 mol·L-1 NaOH溶液混合,放出0.572kJ热量,该反应的中和热为______________,用离子方式表示该反应中和热的热化学方程式:_________________________________________。
(2)已知:H2(g)+![]() O2(g)=H2O(g),反应过程中能量变化如图所示
O2(g)=H2O(g),反应过程中能量变化如图所示
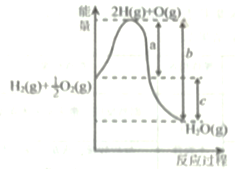
已知:a、b、c表示数值(均为正数),下列对a、b、c说法正确的是_____。
A.a表示此反应正反应速率的活化能。
B.![]() 表示O-H键的键能
表示O-H键的键能
C.c表示此反应的反应热△H
D.b表示1摩尔H2O(g)具有的内能
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1 mol S(s)转化为气态硫原子吸收能量280kJ,F-F键能为160 kJ·mol-1,S-F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式______________________________________________。
【答案】57.2k/mol H+(aq)+OH-(aq)=H2O(l)H=-57.2kJ/mol B S(s)+3F2(g)= SF6(g) △H=-1220 kJ·mol-1
【解析】
(1)反应时,碱过量,用酸计算,中和热为生成1mol液态水时释放的热量;
(2) A.a表示断裂1molH-H键和0.5molO=O键吸收的能量,为此反应正反应的活化能;
B.b表示形成2molO-H键释放的热量,则![]() 表示O-H键的键能;
表示O-H键的键能;
C.c表示此反应的焓变,即△H;
D.b表示形成2molO-H键释放的热量;
(3)化学反应的本质为旧键的断裂,新键的形成。
(1)反应时,碱过量,则c(H+)=0.10×2×50×10-3=0.01mol,即氢离子为0.01mol时,释放0.572kJ的热量,中和热为生成1mol液态水时释放的热量,即H=-![]() =-
=-![]() =-57.2kJ/mol;中和热的离子方程式为H+(aq)+OH-(aq)=H2O(l)H=-57.2kJ/mol;
=-57.2kJ/mol;中和热的离子方程式为H+(aq)+OH-(aq)=H2O(l)H=-57.2kJ/mol;
(2) A.a表示断裂1molH-H键和0.5molO=O键吸收的能量,为此反应正反应的活化能,与题意不符,A错误;
B.b表示形成2molO-H键释放的热量,则![]() 表示O-H键的键能,符合题意,B正确;
表示O-H键的键能,符合题意,B正确;
C.c表示此反应的焓变,即△H,与题意不符,C错误;
D.b表示形成2molO-H键释放的热量,与题意不符,D错误;
答案为B;
(3)化学反应的本质为旧键的断裂,新键的形成,根据S(s)+3F2(g)= SF6(g),断开1 mol S(s),3molF-F键,同时形成6molS-F键,则△H=280+160×3-330×6=-1220 kJ·mol-1。

【题目】下列实验方案能达到实验目的是![]()
选项 | 实验方案 | 实验目的或结论 |
A | 取一个小木条,放入饱和硅酸钠溶液中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,木条未燃烧 | 证明硅酸钠可作木材防火剂 |
B | 向取好未知浓度氢氧化钠溶液的锥形瓶中加入2mL酚酞,然后进行正确滴定,最后一滴盐酸滴入,溶液由红色变为无色且半分钟不恢复 | 准确判断已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的滴定的终点 |
C | 向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体先通入饱和碳酸氢钠溶液,再通入苯酚钠溶液中,苯酚钠溶液产生浑浊 | 酸性:醋酸 |
D | 向盛有苯酚的浓溶液的试管里逐滴加入稀溴水,边滴边振荡 | 苯酚的定性检验 |
A.AB.BC.CD.D