题目内容
PbO2在酸性溶液中能将Mn2+氧化成MnO4-,本身被还原为Pb2+.取一支试管,加入适量PbO2固体和适量的稀H2SO4后滴入2mL 1mol/L MnSO4溶液.下列说法错误的是( )
| A、充分振荡后静置,溶液颜色变为紫色 |
| B、上述实验中不能用盐酸代替硫酸 |
| C、在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 |
| D、若上述实验完全反应,消耗PbO2的物质的量为0.01mol |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:PbO2和稀H2SO4及 MnSO4溶液发生反应的离子方程式为:5PbO2+4H++2Mn2+=2MnO4-+5Pb2++2H2O,
A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,高锰酸根离子为紫色;
B.用盐酸代替硫酸,氯离子会被PbO2氧化;
C.氧化剂的氧化性大于氧化产物;
D.根据锰离子的物质的量结合离子方程式进行计算.
A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,高锰酸根离子为紫色;
B.用盐酸代替硫酸,氯离子会被PbO2氧化;
C.氧化剂的氧化性大于氧化产物;
D.根据锰离子的物质的量结合离子方程式进行计算.
解答:
解:PbO2和稀H2SO4及 MnSO4溶液发生反应的离子方程式为:5PbO2+4H++2Mn2+=2MnO4-+5Pb2++2H2O,
A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,溶液颜色变为紫色,故A正确;
B.用盐酸代替硫酸,氯离子会被PbO2氧化,4H++2Cl-+PbO2═Cl2↑+Pb2++2H2O,故不能用盐酸代替硫酸,故B正确;
C.反应中氧化剂PbO2的氧化性大于氧化产物MnO4-,故C正确;
D.2mL1mol/LMnSO4溶液中的锰离子的物质的量为0.002×1=0.002mol,根据反应离子方程式可知消耗PbO2的物质的量为0.002×
=0.005mol,故D错误,
故选D.
A.充分振荡后静置,发生氧化还原反应生成高锰酸根离子,溶液颜色变为紫色,故A正确;
B.用盐酸代替硫酸,氯离子会被PbO2氧化,4H++2Cl-+PbO2═Cl2↑+Pb2++2H2O,故不能用盐酸代替硫酸,故B正确;
C.反应中氧化剂PbO2的氧化性大于氧化产物MnO4-,故C正确;
D.2mL1mol/LMnSO4溶液中的锰离子的物质的量为0.002×1=0.002mol,根据反应离子方程式可知消耗PbO2的物质的量为0.002×
| 5 |
| 2 |
故选D.
点评:本题考查氧化还原反应的相关知识,难度不大,要注意氧化剂的氧化性大于氧化产物的氧化性.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
下列离子方程式的书写中,正确的是( )
| A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O |
| C、碳酸氢钠溶液中滴入稀盐酸:HCO3-+H+═CO2↑+H2O |
| D、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
根据转化关系判断下列说法不正确的是( )


| A、反应①中,(C6H10O5)n可表示淀粉或纤维素 |
| B、反应②中,1mol葡萄糖可生成2mol乙醇 |
| C、乙醇、乙酸和乙酸乙酯互为同系物 |
| D、将铜丝在空气中灼烧后趁热插入乙醇中可得到乙醛 |
下列反应中反应物的总能量小于生成物的总能量的是( )
| A、电解水制取H2和O2 |
| B、甲烷燃烧 |
| C、铝粉与氧化铁粉末反应 |
| D、油脂在人体内完全氧化生成CO2和H2O |
关于下列装置说法不正确的是( )
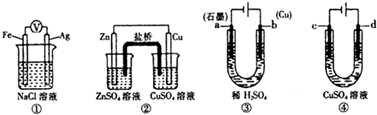

| A、装置①中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 | ||||
| B、装置②盐桥中的阳离子移向ZnSO4溶液 | ||||
C、装置③中反应的离子方程式为:Cu+2H+
| ||||
| D、用装置④精炼铜时,d电极为粗铜 |
有Na2CO3、NaHCO3、CaO和NaOH组成的混合物28.2g,把它们溶于足量的水,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将容器中的水分蒸干,最后得到白色固体物质共30g.则下列有关叙述错误的是( )
| A、原混合物中含Na2CO3 0.1mol |
| B、原混合物中n(Na2CO3)+n(NaHCO3)=n(CaO) |
| C、30g固体中一定存在n(CaCO3)>n(NaOH) |
| D、不能确定原混合物中NaOH的质量 |
下列措施中,能减慢化学反应速率的是( )
| A、食物储存在冰箱里 |
| B、将块状固体药品研细后再反应 |
| C、用MnO2作H2O2分解反应的催化剂 |
| D、用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
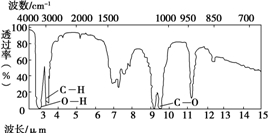 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题: