题目内容
某醇的蒸气密度是相同状况下氢气的31倍,6.2g这种醇完全燃烧时生成8.8g CO2和5.4g H2O,若将6.2g这种醇跟足量的金属钠反应后生成2.24L标准状况下的H2.试回答下列问题:
(1)该醇的分子式为 ;结构简式为 .
(2)该醇与钠反应的化学方程为: .
(3)在浓硫酸、140℃的条件下,该醇可生成六元环状化合物,试写出该反应的化学方程式: .
(1)该醇的分子式为
(2)该醇与钠反应的化学方程为:
(3)在浓硫酸、140℃的条件下,该醇可生成六元环状化合物,试写出该反应的化学方程式:
考点:有关有机物分子式确定的计算
专题:有机物分子组成通式的应用规律
分析:某醇的蒸气密度是相同状况下氢气的31倍,则该醇的相对分子质量=32×2=62,6.2g这种醇完全燃烧时生成8.8g CO2和5.4g H2O,醇、CO2、H2O的物质的量分别为0.1mol、0.2mol、0.3mol,根据原子守恒可知,该醇分子中C原子数目为2、H原子数目为6,故O原子数目=
=2,故该醇分子式为C2H6O2,
若将6.2g这种醇跟足量的金属钠反应后生成2.24L标准状况下的H2,氢气物质的量为0.1mol,可推知该醇分子中有2个-OH,故有机物结构简式为HOCH2CH2OH,据此解答.
| 62-12×2-6 |
| 16 |
若将6.2g这种醇跟足量的金属钠反应后生成2.24L标准状况下的H2,氢气物质的量为0.1mol,可推知该醇分子中有2个-OH,故有机物结构简式为HOCH2CH2OH,据此解答.
解答:
解:(1)某醇的蒸气密度是相同状况下氢气的31倍,则该醇的相对分子质量=32×2=62,
6.2g这种醇完全燃烧时生成8.8g CO2和5.4g H2O,6.2g醇的物质的量=
=0.1mol、CO2的物质的量=
=0.2mol、H2O的物质的量=
=0.3mol,
根据原子守恒可知,该醇分子中C原子数目=
=2、H原子数目=
=6,故O原子数目=
=2,故该醇分子式为C2H6O2,
若将6.2g这种醇跟足量的金属钠反应后生成2.24L标准状况下的H2,氢气物质的量为0.1mol,可推知该醇分子中有2个-OH,故有机物结构简式为HOCH2CH2OH,
故答案为:C2H6O2;HOCH2CH2OH;
(2)HOCH2CH2OH与钠反应方程式为:2Na+HOCH2CH2OH→NaOCH2CH2ONa+H2↑,
故答案为:2Na+HOCH2CH2OH→NaOCH2CH2ONa+H2↑;
(3)在浓硫酸、140℃的条件下,HOCH2CH2OH生成六元环状化合物,发生分子间脱水,该反应的化学方程式为:2HOCH2CH2OH
 +2H2O,
+2H2O,
故答案为:2HOCH2CH2OH
 +2H2O.
+2H2O.
6.2g这种醇完全燃烧时生成8.8g CO2和5.4g H2O,6.2g醇的物质的量=
| 6.2g |
| 62g/mol |
| 8.8g |
| 44g/mol |
| 5.4g |
| 18g/mol |
根据原子守恒可知,该醇分子中C原子数目=
| 0.2mol |
| 0.1mol |
| 0.3mol×2 |
| 0.1mol |
| 62-12×2-6 |
| 16 |
若将6.2g这种醇跟足量的金属钠反应后生成2.24L标准状况下的H2,氢气物质的量为0.1mol,可推知该醇分子中有2个-OH,故有机物结构简式为HOCH2CH2OH,
故答案为:C2H6O2;HOCH2CH2OH;
(2)HOCH2CH2OH与钠反应方程式为:2Na+HOCH2CH2OH→NaOCH2CH2ONa+H2↑,
故答案为:2Na+HOCH2CH2OH→NaOCH2CH2ONa+H2↑;
(3)在浓硫酸、140℃的条件下,HOCH2CH2OH生成六元环状化合物,发生分子间脱水,该反应的化学方程式为:2HOCH2CH2OH
| 浓硫酸 |
| 140℃ |
 +2H2O,
+2H2O,故答案为:2HOCH2CH2OH
| 浓硫酸 |
| 140℃ |
 +2H2O.
+2H2O.
点评:本题考查有机物的推断,侧重于有机物的结构和性质的考查,题目难度中等,注意掌握醇的性质.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
常温下,下列说法正确的是( )
| A、将pH=2的酸溶液稀释10倍,溶液的pH一定变为3 |
| B、将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶液的pH变为3 |
| C、将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13 |
| D、将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7,则a+b=14 |
关于下列装置说法不正确的是( )
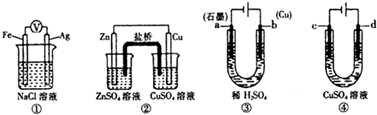

| A、装置①中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 | ||||
| B、装置②盐桥中的阳离子移向ZnSO4溶液 | ||||
C、装置③中反应的离子方程式为:Cu+2H+
| ||||
| D、用装置④精炼铜时,d电极为粗铜 |
下列措施中,能减慢化学反应速率的是( )
| A、食物储存在冰箱里 |
| B、将块状固体药品研细后再反应 |
| C、用MnO2作H2O2分解反应的催化剂 |
| D、用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应 |
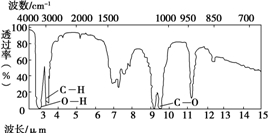 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题: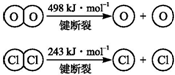
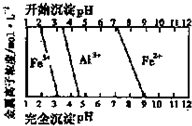 氧化铁在工业上具有广泛的应用.
氧化铁在工业上具有广泛的应用.