��Ŀ����
����Ŀ�������£���ʢ50mL0.100mol��L-1����������ձ��и������ٵμ�50mL������ˮ��0.100mol��L-1�������Һ�������ҺpH��ʱ��仯��ͼ��ʾ����֪Ka(CH3COOH)=1.8��10-5��Kb(NH3��H2O)=1.8��10-5������˵����ȷ���ǣ� ��
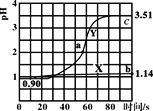
A.����X������μ�����ˮ��pH�仯ͼ���μӹ�������Һ��������Ũ����С
B.����Y�ϵ�����һ����Һ�о�����c(CH3COO-)<c(NH4+)
C.a����Һ��n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.01mol
D.b����Һ��ˮ�����c(H+)��c���102.37��
���𰸡�B
��������
HCl�м�ˮ���500mL��������101������ʱPH=1+1=2�����ڼ�50mlˮ����Һ���ԶԶС��500mL�����Լ�50mLˮ����ҺPH��2С����X������50mLˮ�ģ�Y�������˴���淋ģ��ݴ˻ش�
A���ɷ�����֪����X�������еμ�ˮ��pH�仯ͼ��HCl��ϡ�ͣ�H+��Cl-Ũ�ȼ�С������Kw=[H+]��[OH-]��֪��[OH-]������A����
B. ������50mL���ᰴʱ������狀�HClǡ����ȫ��Ӧ������Ϊ�����ʵ�����Ũ�Ⱦ�Ϊ0.05mol��L-1��CH3COOH��NH4Cl��CH3COO-Ũ�������ΪKa(CH3COOH)=1.8��10-5������C(CH3COO-)=![]() ����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
C. a����Һ�е���غ�Ϊ��n(Cl-)��n(CH3COO-)��n(OH)= n(NH4+)+n(H+)������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)= n(H+)��a��pH=2��C(H+)=0.01mol��L-1����Һ�����ԼΪ100ml��n(H+)=0.01mol��L-1��0.1L=0.001mol������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.001mol��C����
D. b��λHCl��Һ��ˮ�ĵ����ܵ�HCl�����H+���ƣ�c�㣺һ����CH3COOHΪ���ᣬ��һ���棬NH4+ˮ��ٽ�ˮ�ĵ��룬�ۺ�����b��ˮ�ĵ��������Ƴ̶ȴ���c�㣬D����
��ѡB��

����Ŀ��������(NaBiO3)�Ƿ�����ѧ�е���Ҫ�Լ�����ˮ�л����ֽ⣬����ˮ������Ѹ�ٷֽ⡣ij��ȤС�����ʵ����ȡ�����Ʋ�̽����Ӧ�á��ش��������⣺
����ȡ������
��ȡװ����ͼ(���Ⱥͼг���������ȥ)�����������������£�
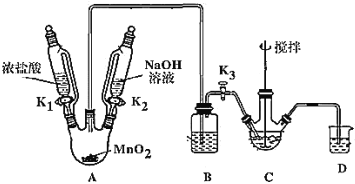
���� | NaBiO3 | Bi(OH)3 |
���� | ��������ˮ��dz��ɫ | ������ˮ����ɫ |
(1)װMnO2������������_____________��Bװ�����ڳ�ȥHCl��ʢ�ŵ��Լ���________________��
(2)C��ʢ��Bi(OH)3��NaOH������Cl2��Ӧ����NaBiO3����Ӧ�����ӷ���ʽΪ_____��
(3)���۲쵽_____(������)ʱ�����Գ����ж� C �з�Ӧ�Ѿ���ɣ�
(4)���װ��ǰ�����ȳ�ȥ��ƿ�в���Cl2������Ⱦ��������ȥCl2�IJ�����_______��
(5)��Ӧ������Ϊ��װ��C�л�þ����ܶ�IJ�Ʒ����Ҫ�IJ�����____________�����ˡ�ϴ�ӡ����
��Ʒ���ȵIJⶨ
(6)ȡ����NaBiO3��Ʒw g����������ϡ�����MnSO4ϡ��Һʹ����ȫ��Ӧ������ c mo1/L��H2C2O4����Һ�ζ����ɵ�MnO4-(��֪��H2C2O4+MnO4---CO2+Mn2++H2O��δ��ƽ)������Һ�Ϻ�ɫǡ����ȥʱ������V mL����Һ���ò�Ʒ�Ĵ���Ϊ ______________(�ú� w��c��V�Ĵ���ʽ��ʾ)��