题目内容
17.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)Ⅱ;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都能发生的反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;与实验Ⅲ相比,实验Ⅳ的优点是操作简便;
(3)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是错误(填“正确”或“错误”)的.
(4)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法.
①焰色反应;②滴加氯化钡溶液.

分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;Ⅳ可以做到用一套装置同时进行两个对比实验,具有较强的对照性;
(3)加入澄清石灰水,均反应生成碳酸钙沉淀;
(4)阳离子不同,阴离子不同,结合性质差异鉴别.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O,图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;操作简便;
(3)加入澄清石灰水,均反应生成碳酸钙沉淀,现象相同,不能鉴别,则说法错误,故答案为:错误;
(4)阳离子不同,利用焰色反应可鉴别,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3;阴离子不同,滴加氯化钡溶液可鉴别,滴加氯化钡生成白色沉淀的为K2CO3,无现象的是NaHCO3,故答案为:焰色反应;滴加氯化钡溶液.
点评 本题考查物质的性质及鉴别,为高频考点,把握碳酸钠、碳酸氢钠的性质差异为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 纯碱、烧碱均属于碱 | B. | Na2O、CaO均属于碱性氧化物 | ||
| C. | 凡能电离出H+的化合物均属于酸 | D. | 盐类物质一定含有金属离子 |

已知:①A、B、C、D、G含有同种元素X.
②
| 物质 | 纯A (单质) | B(溶液) | C(固体) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 棕黄色 | 红褐色 | 红棕色 | 浅绿色 |
试回答下列问题:
(1)元素X在元素周期表中的位置为第四周期第Ⅷ族,D的化学式为Fe2O3.
(2)G生成C的过程中出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;G与Cl2反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
| A. | 15:4 | B. | 3:1 | C. | 4:15 | D. | 1:3 |
| A. | 苯 | B. | 己烯 | C. | CCl4 | D. | KI |
| A. | 7.2 g | B. | 4.2 g | C. | 3.6 g | D. | 2.1 g |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2<p3 | D. | α1+α2>1 |
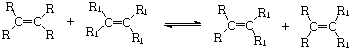
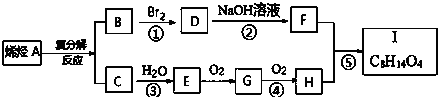
 .
.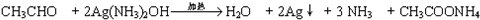 .
.