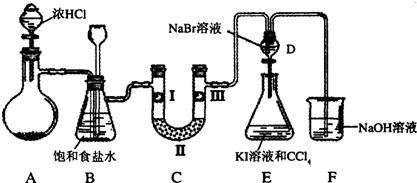
题目内容
14.实验室需要65mL 1.0mol/L的NaCl溶液用于测定AgNO3溶液的浓度.(1)用NaCl固体配制NaCl溶液时必须用到的仪器是①②③⑤⑦(填序号).
①天平 ②烧杯 ③玻璃棒 ④酒精灯 ⑤胶头滴管 ⑥50mL容量瓶⑦100mL容量瓶
(2)需要称取NaCl固体的质量是5.9g.
(3)量取20mL AgNO3溶液,当加入25mL 1.0mol/L NaCl溶液时恰好完全反应,则c(AgNO3)=1.25mol/L.
分析 (1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据m=CVM来计算;
(3)设出硝酸银溶液的浓度为Xmol/L,根据AgNO3与NaCl的反应列式计算.
解答 解:(1)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故答案为:①②③⑤⑦;
(2)由于实验室无65mL的容量瓶,故应选用100mL的容量瓶,配置出100mL的溶液,故所需的氯化钠的质量m=CVM=1mol/L×0.1L×58.5g/mol=5.9g,故答案为:5.9g;
(3)设AgNO3溶液的浓度为Xmol/L,根据AgNO3与NaCl的反应可知:
AgNO3 +NaCl=AgCl↓+NaNO3
1 1
Xmol/L×0.02L 1mol/L×0.025L
可知有:Xmol/L×0.02L=1mol/L×0.025L
解得X=1.25 mol/L.
故答案为:1.25 mol/L.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和仪器的选择,属于基础型题目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法中正确的是(NA为阿伏加德罗常数)( )
| A. | 48gO3气体含有NA个O3分子 | |
| B. | 7.8gNa2O2含有0.2NA个阴离子 | |
| C. | 27gAl含有电子的总数为3NA个 | |
| D. | 标准状况下,22.4LH2O中含有NA个氧原子 |
2.常温下,下列物质属于电解质但不能导电的是( )
| A. | 蔗糖溶液 | B. | 氯化钠溶液 | C. | 氢氧化钠 | D. | 稀硫酸 |
9.下列实验现象与氧化还原反应有关的是( )
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | NO气体遇空气由无色变为红棕色 | |
| C. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
19.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液,⑥蒸发.正确的操作顺序是( )
| A. | ①④②⑤①③⑥ | B. | ①②⑤④①③⑥ | C. | ①④②⑤③①⑥ | D. | ①②⑤④③①⑥ |
6.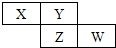 X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
 X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )
X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法不正确的是( )| A. | Y的氢化物在常温下为液态 | |
| B. | 最高价氧化物对应水化物的酸性:W>Z | |
| C. | 最低价氢化物稳定性:Y>X | |
| D. | 原子半径:W>Z>Y>X |
16.下列有关化学用语表示正确的是( )
| A. | 18O2-结构示意图: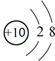 | |
| B. | Na2O2的电子式: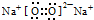 | |
| C. | HCO3- 的水解方程式HCO3-+H2O?H2CO3+OH- | |
| D. | HI的电离方程式 HI?H++I- |