题目内容
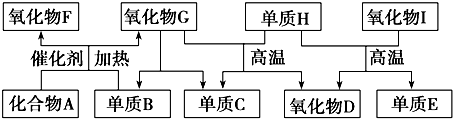
12.某兴趣活动小组利用物质间的互变,设计成一个平面“魔方”,如图所示.
已知:①A、B、C、D、G含有同种元素X.
②
| 物质 | 纯A (单质) | B(溶液) | C(固体) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 棕黄色 | 红褐色 | 红棕色 | 浅绿色 |
试回答下列问题:
(1)元素X在元素周期表中的位置为第四周期第Ⅷ族,D的化学式为Fe2O3.
(2)G生成C的过程中出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;G与Cl2反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
分析 E是通常情况下密度最小的气体,E是H2,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明B中有氯元素,B溶液显棕黄色,又知B具有氧化性,B能反应生成C,C固体是红褐色,为Fe(OH)3,则B是FeCl3,根据图示,D为Fe2O3,则A、B、C、D、G含有同种元素X为铁元素,所以A为Fe,在水溶液中B也能将一种氧化物氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G,则F为H2SO4,硫酸与铁反应生成E、G,G溶液为浅绿色,所以G为FeSO4,以此来回答在周期表中的位置、化学式、反应现象等问题.
解答 解:E是通常情况下密度最小的气体,E是H2,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明B中有氯元素,B溶液显棕黄色,又知B具有氧化性,B能反应生成C,C固体是红褐色,为Fe(OH)3,则B是FeCl3,根据图示,D为Fe2O3,则A、B、C、D、G含有同种元素X为铁元素,所以A为Fe,在水溶液中B也能将一种氧化物氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G,则F为H2SO4,硫酸与铁反应生成E、G,G溶液为浅绿色,所以G为FeSO4,
(1)Fe在元素周期表中的位置为第四周期第Ⅷ族,D为Fe2O3,
故答案为:第四周期第Ⅷ族;Fe2O3;
(2)G为硫酸亚铁,加入碱生成白色的氢氧化亚铁,氢氧化亚铁不稳定,易与氧气反应生成红褐色的氢氧化铁沉淀,
故答案为:先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色;
(3)氢气具有还原性,在加热条件下与四氧化三铁反应生成单质铁,反应方程式为4H2+Fe3O4 $\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;铁与强氧化剂氯气反应生成最高价态的氯化铁,反应方程式为2Fe+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:4H2+Fe3O4 $\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;2Fe+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(4)Fe3+具有氧化性,SO2具有还原性,二者发生氧化还原反应生成Fe2++和SO42-离子,反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,G为FeSO4,G与Cl2反应,氯气将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查属于物质的推断题目,考查电子式的书写,周期表中的位置、物质的性质,本题的突破口在于一些物质的特殊性质,在学习中要注意积累.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | NO气体遇空气由无色变为红棕色 | |
| C. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| A. | 2-乙基丁烷 | B. | 2-甲基丁烷 | C. | 3-甲基戊烷 | D. | 2,2-甲基戊烷 |
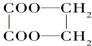 时最简便的流程需经下列哪些反应( )
时最简便的流程需经下列哪些反应( )①取代 ②加成 ③氧化 ④还原 ⑤消去 ⑥酯化.
| A. | ①②③④⑥ | B. | ⑤②①③⑥ | C. | ⑥③①②⑤ | D. | ①②⑤③⑥ |
(1)写出瓦斯爆炸的化学方程式CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.
(2)可燃性气体的爆炸都有一个爆炸极限,所谓爆炸极限是指可燃气体(或蒸汽或粉尘等)与空气混合后,遇火产生爆炸的最高或最低浓度(通常以体积百分数表示).下表是甲烷在空气和纯氧气中的爆炸极限.
| 空气中 | 纯氧气中 | |
| 甲烷的爆炸极限 | 5.0~15% | 5.0~60% |
A.3% B.10% C.30% D.60%
(3)由矿井中的瓦斯爆炸,根据你的化学实验经验,你可以得出什么启示?(提示:对可燃性气体的加热、点燃操作应该注意的问题)可燃性气体的加热、点燃操作前必须进行验纯操作.
| 金属 | 酸溶液 | 温度 | |
| A | Mg | 0.5mol•L-1H2SO4 | 30℃ |
| B | Fe | 1mol•L-1HCl | 20℃ |
| C | Zn | 2mol•L-1HCl | 20℃ |
| D | Mg | 18.4mol•L-1H2SO4 | 30℃ |
| A. | A | B. | B | C. | C | D. | D |
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是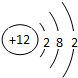

 .
.