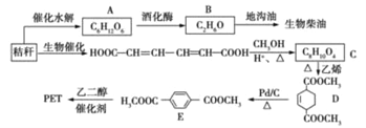
题目内容
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]()
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ= kaⅡ且kbⅠ= kbⅡ,则x的值可以为任何值
【答案】A
【解析】
A.反应达到平衡状态时正逆反应速率相等,v正=ka·w(H2)·w(I2)=v逆=kb·w2(HI);则![]() w2(HI)/ w(H2)·w(I2)
w2(HI)/ w(H2)·w(I2)
B.结合三行计算列式得到碘化氢消耗量,计算反应速率v=△c/△t;
C.计算此时浓度商和平衡常数比较判断反应进行的方向;
D.若两容器中kaⅠ= kaⅡ且kbⅠ= kbⅡ,说明I和 II达到相同平衡状态。
H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
起始量(mol/L)0.5 0.5 0
变化量(mol/L) n n 2n
平衡量(mol/L)0.5-n 0.5-n 2n
w (HI)/%= 2n/1=80%,n=0.4 mol/L,平衡常数K=64;
A. 反应达到平衡状态时正逆反应速率相等,v正=ka·w(H2)·w(I2)=v逆=kb·w2(HI);则![]() w2(HI)/ w(H2)·w(I2)=K=64;故A正确;
w2(HI)/ w(H2)·w(I2)=K=64;故A正确;
B. 容器I中在前20 min, H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) m m 2m
平衡量(mol/L) 0.5-m 0.5-m 2m
w (HI)/%= 2m/1=50%,m=0.25 mol/L,容器I中在前20 min的平均速率,
v(HI)= 0.5 molL-1/20min=0.025 mol·L-1·min-1;故B错误;
C. 若起始时,向容器I中加入物质的量均为0.lmol的H2、I2、 HI, 此时浓度商Qc=0.12/0.1× 0.1=1<K=64,反应正向进行,故C错误;
D. 若两容器中kaⅠ= kaⅡ且kbⅠ= kbⅡ, 为恒容条件下的等效平衡, w(HI)/%为80%,
则x的值一定为1,故D错误;
故选A。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸H2C2O4溶液在室温下进行反应。实验中所用的草酸为稀溶液,视为强酸。
(1)写出硫酸酸化的高锰酸钾氧化稀草酸溶液的离子方程式__________。
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率___________(填“增大”或“减小”)。但分析该实验数据,得到的结论是在当前实验条件下,增大草酸浓度,反应速率减小。
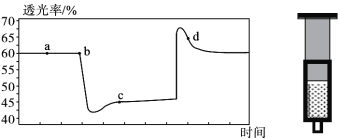
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。
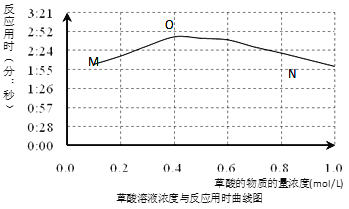
该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是___________。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是____________________________________________。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因________________。
a.当草酸浓度较小时,C2O42-起主要作用,草酸浓度越大,反应速率越小
b.当草酸浓度较小时,H+起主要作用,草酸浓度越大,反应速率越大
c.当草酸浓度较大时,C2O42-起主要作用,草酸浓度越大,反应速率越小
d.当草酸浓度较大时,H+起主要作用,草酸浓度越大,反应速率越大
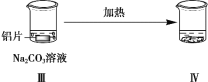
【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的