题目内容
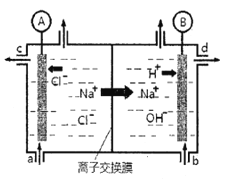
【题目】(1)氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
①写出电解饱和食盐水的离子方程式_________。
②离子交换膜的作用为:__________、__________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
(2)已知在强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-。
①此反应的离子方程式是_________。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
【答案】 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
【解析】(1)①电解饱和食盐水的反应为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②使用阳离子交换膜进行电解,主要是为了解决两个问题:1、电解生成氢气和氯气,两种气体接触可能会发生爆炸;2、随着电解的进行,溶液显碱性,而电解生成的氯气如果和碱接触就会发生反应。因此,答案为:阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③阴极上水电离的氢离子得电子转化为氢气,剩余水电离的氢氧根离子,同时阳极的钠离子穿过阳离子交换膜进入阴极,所以在阴极得到大量的氢氧化钠,所以氢氧化钠从d口流出。
(2)①强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-,同时KClO化合价降低,一定转化为KCl。碱性条件,反应物中应该有氢氧根离子,根据化合价升降相等、电荷守恒和原子个数守恒得到方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。
3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。