��Ŀ����
����Ŀ������Ҫ�����:
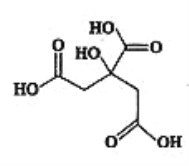
��1��FeSO4��ת��ΪFeCO3,FeCO3�ڿ����м��ȿ��Ƶ���ϵ���������
��֪25��,101kPaʱ:4Fe(s)+3O2(g)=2Fe2O3(s)��H=-1648kJ/mol
C(s)+O2(g)=CO2(g) ��H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ��H=-1480kJ/mol
FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽΪ_______.
��2��ij�¶�ʱˮ�����ӻ�Kw=1.0��10-13,����¶�ʱ��ˮ��pH____7(����>������<������=��)�����¶���,pH=2��CH3COOH��Һ�У�c(OH-)=_________��
��3����2��0.1mol/LCH3COONa��Һ�зֱ��������NH4NO3��Na2SO3����(��������仯)����CH3COO-Ũ�ȵı仯����Ϊ_____��______ (������С��������������������)��
��4��ͬŨ�ȵ�NaA��NaB������ҺpHǰ�ߴ��ں��ߣ��Ƚ�������Һ����������������Ũ�ȴ�С, NaA_______NaB (��">������<������=")��
��5��25��ʱ��ij��Һ��Fe3+��Ũ��Ϊ0.010mol/L,ʹFe3+������ȫ��pHΪ____��(Ksp[Fe(OH)3]=4��10-38,1g2=0.3)
���𰸡� 4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=��260kJmol��1 < 10-11 mol/L ��С ���� < 3.2
����������1������Ŀ������������Ӧ����Ϊ�٢ڢۣ���Ӧ����4����Ӧ����2����Ӧ�۵õ���4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=��260kJmol��1��
��2��KW=c(H+)��c(OH-)=1.0��10-13����ˮ�е�c(H+)��c(OH-)һ����ȣ�����c(H+)= ![]() ������pH=6.5��7�����¶���,pH=2��CH3COOH��Һ�У�c(H+)=1��10-2mol/L������c(OH-)=
������pH=6.5��7�����¶���,pH=2��CH3COOH��Һ�У�c(H+)=1��10-2mol/L������c(OH-)= ![]() ��
��
��3��CH3COONa��Һ�м�������NH4NO3����������淋��������笠����ӻᷢ��ˮ�������ڴ�������ӵ�ˮ���ٽ����������Դ�������ӵ�Ũ�ȼ�С��CH3COONa��Һ�м�������Na2SO3���壬�������Ƶ�������������������ˮ�⣬���ڴ�������ӵ�ˮ�����������ã����Դ��������Ũ������ע�⣺�������Ӷ�ˮ��Ӧ�û���ٽ������������ӻ��߶���������ˮ��Ӧ�û������ƣ�
��4��������Һ�и��Դ��������غ���c(H+) + c(Na+) = c(OH-) + c(A-)��c(H+) + c(Na+) = c(OH-) + c(B-)������������Һ��������Ũ�ȶ��Ǹ��Ե�2[c(H+) + c(Na+)]������Ϊ������Һ��c(Na+)���������c(H+)�������Һ����������Ũ��һ��������ͬŨ�ȵ�NaA��NaB������ҺpHǰ�ߴ��ں��ߣ�����NaB��pH��С��������Ũ�ȸ�����Һ��������Ũ�ȸ���ΪNaA��NaB��
��5��ǡ����ȫ����ʱ����Ϊc(Fe3+)=1��10-5mol/L������KSp���Լ���![]() ������
������![]() ������
������ ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������������һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ���������ƾ���(Na2S2O3��5H2O)��
����[��������]
��1��Na2S2O3��5H2O����ɫ�����壬������ˮ����ϡ��Һ��BaCl2��Һ����������ɡ�
��2����Na2CO3��Na2S���Һ��ͨ��SO2���Ƶ�Na2S2O3�����ò�Ʒ�г���������Na2SO3��Na2SO4��
��3��Na2SO3�ױ�������BaSO3������ˮ��������ϡHCl��
��4�������������ⷴӦ�����ӷ���ʽΪ��2S2O32-+I2=S4O62-+2I-
����[�Ʊ���Ʒ]ʵ��װ����ͼ��ʾ(ʡ�Լг�װ��)

ʵ�鲽�裺
��1������ͼ��ʾ��װ��װ�ú�Ӧ��_______________(���������)���ٰ�ͼʾ�����Լ�������B��D��������____________________________��E�е��Լ���__________(ѡ��������ĸ���)��
A��ϡH2SO4 B��NaOH��Һ C������NaHSO3��Һ
��2��������ƿC�м���Na2S��Na2CO3�����Һ��������ƿA�еμ�ŨH2SO4��C�з�Ӧ����Na2S2O3��CO2����ѧ����ʽΪ______________________��
��3����Na2S��Na2CO3��ȫ���ĺ�����Ӧ������C�л��Һ����Һ���������ᾧ�����ˡ�ϴ�ӡ�����õ���Ʒ��
����[̽���뷴˼]
��1��Ϊ��֤��Ʒ�к���Na2SO3��Na2SO4����С�����������ʵ�鷽�����뽫��������������(�����Լ���ϡHNO3��ϡH2SO4��ϡHCl������ˮ��ѡ��)��
ȡ������Ʒ���ϡ��Һ���μ�����BaCl2��Һ���а�ɫ�������ɣ�____________��������δ��ȫ�ܽ⣬���д̼�����ζ��������������ȷ����Ʒ�к���Na2SO3��Na2SO4��
��2����I2�ı���Һ�ⶨ��Ʒ�Ĵ���
ȡ10.0g��Ʒ�����Ƴ�100mL��Һ��������Һ������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������__________��������̼��ȡ10.00mL��Һ����________��ҺΪָʾ������Ũ��Ϊ0.10mol/LI2�ı��ܲ����еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����I2����Һ�����/mL | 19.95 | 17.10 | 20.05 |
�ζ�ʱ���ﵽ�ζ��յ��������___________________________________________��Na2S2O3��5H2O�ڲ�Ʒ�е�����������_______________(�ðٷ�����ʾ���ұ���1λС��)��