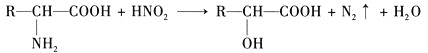
题目内容
【题目】锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3 以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
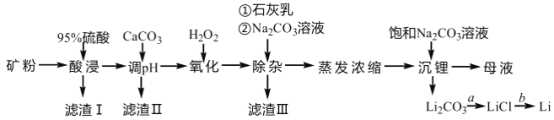
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3 在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____。
(2)滤渣 I 的主要成分是_____。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________。
(3) “沉锂”过程中发生反应的离子方程式是_____。用热水洗涤 Li2CO3 固体,而不用冷水洗涤,其原因是_____。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____。
(5)工业上实现过程 b 常用的方法是_____。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2 的还原能力。LiAlH4 的“ 有效氢”为_____(保留 2 位小数)。
【答案】将矿石粉粹成矿粉,使用较浓的硫酸 SiO2 Fe2+、Ca2+、Mg2+ 2Li+ + CO32- = Li 2CO3↓ Li2CO3 在水中溶解度随着温度升高而减小,用热水洗涤可降低其溶解度,减少损耗 用足量盐酸溶解,在 HCl 气流中蒸干 电解法 0.21
【解析】
矿粉的主要成分为 Li2O、SiO2、Al2O3 以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子,加入95%的浓硫酸进行酸浸,只有SiO2不溶而成为滤渣I,滤液中加入CaCO3调pH,此时Fe3+转化为Fe(OH)3沉淀,Al3+转化为Al(OH)3沉淀,此为滤渣II的主要成分;加入H2O2将Fe2+氧化为Fe3+,再加入石灰乳、Na2CO3溶液,Fe3+、Ca2+、Mg2+转化为沉淀,成为滤渣Ⅲ的主要成分。此时所得滤液中的阳离子主要为Li+、Na+等,蒸发浓缩、加入饱和Na2CO3溶液,Li+转化为Li2CO3沉淀,再用盐酸溶解并在HCl气流中蒸干,即可获得无水LiCl,再熔融电解即可得到Li。
(1)为提高“酸浸”速率,可增大接触面积、升温、适当增大浓度、不断搅拌等,因此上述流程中采取的措施有将矿石粉粹成矿粉,使用较浓的硫酸。答案为:将矿石粉粹成矿粉,使用较浓的硫酸;
(2)加入硫酸溶解,只有SiO2不溶,所以滤渣 I 的主要成分是SiO2。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化”时,将Fe2+转化为Fe3+,“除杂”时,将Ca2+、Mg2+转化为沉淀,所以步骤主要除去的离子有Fe2+、Ca2+、Mg2+。答案为:SiO2;Fe2+、Ca2+、Mg2+;
(3) “沉锂”过程中Li+与CO32-反应生成Li 2CO3沉淀,发生反应的离子方程式是2Li+ + CO32- = Li 2CO3↓。因为Li2CO3 在水中溶解度随着温度升高而减小,所以用热水洗涤 Li2CO3 固体,而不用冷水洗涤,其原因是Li2CO3 在水中溶解度随着温度升高而减小,用热水洗涤可降低其溶解度,减少损耗。答案为:2Li+ + CO32- = Li 2CO3↓;Li2CO3 在水中溶解度随着温度升高而减小,用热水洗涤可降低其溶解度,减少损耗;
(4)将Li 2CO3转化为LiCl,则需加入盐酸,同时防止Li+大量水解,简单的实验方案为:用足量盐酸溶解,在 HCl 气流中蒸干。答案为:用足量盐酸溶解,在 HCl 气流中蒸干;
(5)由LiCl制Li,可采用熔融电解的方法,所以工业上实现过程 b 常用的方法是电解法。答案为:电解法;
(6)在LiAlH4中,H显-1价,作还原剂后,失电子转化为H+,由此可得出LiAlH4与H2关系为:LiAlH4—8e-—4H2,LiAlH4的“有效氢”为![]() =0.21。答案为:0.21。
=0.21。答案为:0.21。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
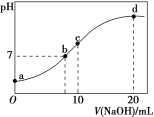
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
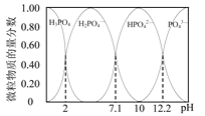
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
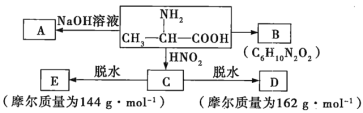
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
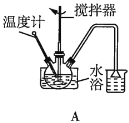
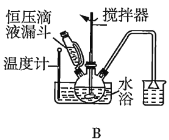
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
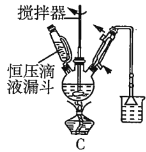
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1