题目内容
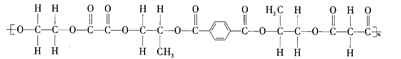
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
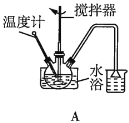
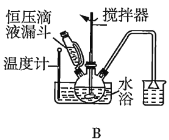
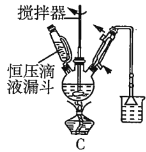
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。
【答案】氧化反应、复分解反应 B 提高葡萄糖酸的转化率 氯化钙与葡萄糖酸不能制得葡萄糖酸钙 葡萄糖酸钙冷却后会结晶析出,若不趁热过滤会损失产品 76.3%
【解析】
葡萄糖溶液中加入3%溴水、温度控制在55℃,温度小于100℃,水浴加热,发生的反应CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr,该反应中生成HBr,为防止污染大气,应该用碱液处理HBr;然后向溶液中加入过量CaCO3、温度控制在70℃,发生反应2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑,葡萄糖酸钙可溶于冷水易溶于热水,趁热过滤,将未溶解的碳酸钙除去,然后向滤液中加入乙醇,葡萄糖酸钙微溶于乙醇,所以得到葡萄糖酸钙悬浊液,然后抽滤得到固体,然后洗涤、干燥固体最后得到Ca(C6H11O7)2固体。
(1)CH2OH(CHOH)4CHO与Br2的反应属于氧化反应,葡萄糖酸与CaCO3的反应属于复分解反应;
(2)第①步中反应在55℃时进行,需要水浴加热,且温度计应放置在外部水槽中,A装置中温度计位置放错,C装置直接用酒精灯加热不易控制温度,所以最合适的装置为B;
(3)过量的CaCO3能使葡萄糖酸尽可能转化为葡萄糖酸钙;
(4)因为盐酸的酸性强于葡萄糖酸,氯化钙和葡萄糖酸不能制得葡萄糖酸钙,而H2CO3的酸性比葡萄糖酸弱,CaCO3能与葡萄糖酸发生复分解反应从而得到葡萄糖酸钙;
(5)温度高,葡萄糖酸钙的溶解度较大,趁热过滤,可以减少葡萄糖酸钙的损失;
(6)9.0gC6H12O6(葡萄糖)的物质的量为![]() ,根据化学方程式可知理论上得到葡萄糖酸钙的物质的量为0.025mol,其质量为0.025mol×430g/mol=10.75g,故葡萄糖酸钙的产率为
,根据化学方程式可知理论上得到葡萄糖酸钙的物质的量为0.025mol,其质量为0.025mol×430g/mol=10.75g,故葡萄糖酸钙的产率为![]() 。
。

【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
【题目】锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3 以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
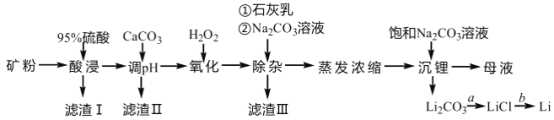
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3 在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____。
(2)滤渣 I 的主要成分是_____。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________。
(3) “沉锂”过程中发生反应的离子方程式是_____。用热水洗涤 Li2CO3 固体,而不用冷水洗涤,其原因是_____。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____。
(5)工业上实现过程 b 常用的方法是_____。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2 的还原能力。LiAlH4 的“ 有效氢”为_____(保留 2 位小数)。
【题目】四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。

已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
物质 | 颜色 | 熔点/℃ | 沸点/℃ |
Sn | 银白色 | 232 | 2260 |
SnCl2 | 白色 | 247 | 652 |
SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
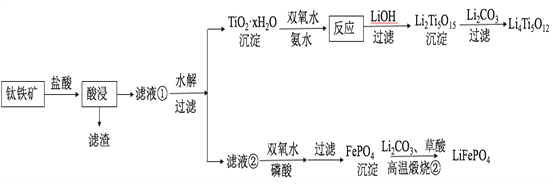
回答下列问题:
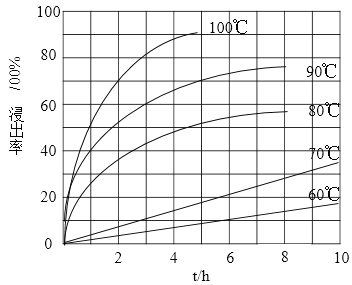
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。