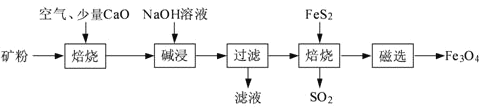
题目内容
【题目】已知X、Y、Z、W、R五种元素均位于周期表的前四周期,且原子序数依次增大。元素X的基态原子中电子占据了三种能量不同的原子轨道,且成对电子数是未成对电子数的2倍;元素Y与W同主族,且Y是地壳中含量最多的元素;Z基态原子有12种不同运动状态的电子;元素R基态原子最外层只有1个电子且内层电子全充满。
请回答下列问题:(答题时,X、Y、Z、W、R用所对应的元素符号表示)
(1)基态Y原子的轨道式表示式为![]() ___。
___。
(2)元素Y、W均可形成含18个电子的氢化物,其中Y的氢化物沸点较高,原因是___;
(3)元素Z与同周期相邻两元素第一电离能由高到低的顺序为___。
(4)元素R在周期表中位于___区,R分别与Y、W形成离子化合物R2Y和R2W,其中熔点较高的为___。
(5)R2+与过量的氨水形成的配离子的化学式为[R(NH3)4]2+,在配离子中与R2+形成配位键的原子是___。
(6)X的一种单质(相邻原子间通过共价键形成空间网状结构)、XY2、WY2、ZW对应的晶体熔沸点由高到低的顺序为___。
【答案】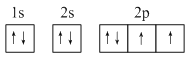 H2O2分子间存在氢键,氢键强于H2S分子间的作用力 Mg>Al>Na ds Cu2O N C(金刚石)>MgS>SO2>CO2
H2O2分子间存在氢键,氢键强于H2S分子间的作用力 Mg>Al>Na ds Cu2O N C(金刚石)>MgS>SO2>CO2
【解析】
元素X的基态原子中电子占据了三种能量不同的原子轨道,分别为1s、2s、2p;成对电子数是未成对电子数的2倍,电子排布式为1s22s22p2,X为C;元素Y与W同主族,且Y是地壳中含量最多的元素,则Y为O,W为S;Z基态原子有12种不同运动状态的电子,则Z为Mg;元素R基态原子最外层只有1个电子且内层电子全充满,R基态原子的电子排布式为[Ar]3d104s1,R为Cu,则X、Y、Z、W、R分别为C、O、Mg、S、Cu。
(1)分析可知,Y为O,氧原子核外有8个电子,则基态O原子的核外电子排布图为![]() ;
;
(2)元素Y、W分别为O、S,形成含18个电子的氢化物,分别为H2O2、H2S,H2O2分子间存在氢键,H2S分子间只存在范德华力,氢键强于H2S分子间范德华力,则H2O2沸点较高;
(3)元素Z为Mg,与其同周期相邻两元素分别为Na、Al,Mg的3s能级为全满状态,较稳定,第一电离能大于Na、Al,而同周期中第一电离能随原子序数的增大有增大的趋势,则第一电离能由高到低的顺序为Mg>Al>Na;
(4)元素R为Cu,位于周期表中的ds区;与O、S形成的Cu2O和Cu2S均为离子晶体,氧离子半径小于硫离子,则Cu2O中离子键强,晶格能大,熔点高;
(5)[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3中的N原子提供孤电子对,形成配位键;
(6)X的一种单质(相邻原子间通过共价键形成空间网状结构)、XY2、WY2、ZW分别为金刚石、CO2、SO2、MgS,金刚石为原子晶体有很高的熔沸点,CO2、SO2为分子晶体,熔沸点与相对分子质量成正比,即熔沸点SO2>CO2,MgS为离子晶体,熔沸点高于分子晶体,低于原子晶体,则晶体熔沸点由高到低的顺序为C(金刚石)>MgS>SO2>CO2。

【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
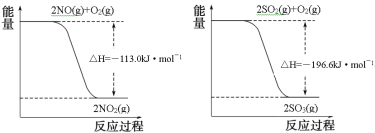
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
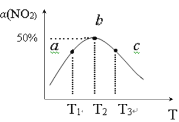
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。