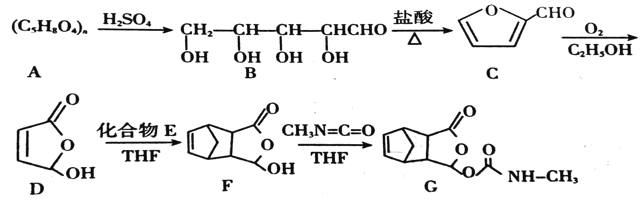
题目内容
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 ![]() 部分生成物和反应条件略去
部分生成物和反应条件略去![]() 。下列推断不正确的是
。下列推断不正确的是![]()
![]()
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是![]()
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
【答案】C
【解析】
A.若D是一种强碱,则A是活泼金属、B是金属氧化物、C可以是金属过氧化物,X是水,故A正确;
B.若D为NaCl,且A可与C反应生成B,A可以是氢氧化钠,B是碳酸钠,C是碳酸氢钠,X是盐酸,故B正确;
C.A是铁,则B是氯化亚铁,C是氯化铁,D是氢氧化铁,故C错误;
D.若D是一种强酸,则A既可以是硫单质或氮气,也可以是硫化氢或氨气,硝酸可与铜反应生成一氧化氮或二氧化氮,故D错误;
故选:C。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】环境监测测定水中溶解氧的方法是:①量取25.00mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-
滴定次数 | 待测液的体积/mL | 0.1000mol·L-1 Na2S2O3的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
试回答:
(1)消耗Na2S2O3的体积平均值为___mL,水中溶解氧的量是(以g/L为单位,保留3位有效数字)___。
(2)滴定(I2和S2O32-反应)以淀粉溶液为指示剂,终点时现象为___。
(3)判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质___。
④待测液的滴定管之前有气泡,取液后无气泡___。
【题目】下列实验“操作和现象”与“结论”对应关系正确的是![]()
操作和现象 | 结论 | |
A | 常温下,将Al箔插入浓 | 铝和浓硝酸不反应 |
B | 向饱和 | 析出了 |
C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 向装有 |
|
A.AB.BC.CD.D
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化