题目内容
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
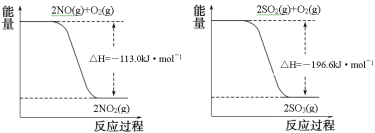
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
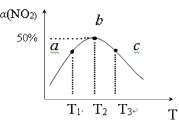
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
【答案】SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8kJ·mol-1 < 0.025mol·L-1·min-1 0.50 不变 温度为T2,b点为平衡点,T2以前温度升高,反应速率加快,NO2转化率增大,T2以后,该反应为放热反应,升高温度,平衡向逆反应方向移动,转化率减小 c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
【解析】
(1)根据两幅图写出各自的热化学方程式再根据盖斯定律书写出正确的SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式;
(2)①温度越高,反应速率越快,由此判断;
②通过NO2的转化率计算转化的物质的量,再根据三段法计算反应速率和平衡常数;在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,由于温度不变,平衡常数不发生变化,据此利用三段法进一步计算转化率;
③根据影响平衡移动的因素进行分析;
(3)由数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液碱性越强,因此吸收液呈中性时,n(SO32-):n(HSO3-)<1:1,且中性时c(H+)=c(OH-),结合电荷守恒可得c(Na+)=2c(SO32-)+c(HSO3-),据此判断;
(1)根据两图可知热化学方程式为:①2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol,②2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6kJ/mol,②-①可得:SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=-41.8kJ·mol-1;
(2)①温度越高,反应速率越快,所以有υ(a)<υ(c);
②温度为T2时从反应开始经过2min达到b点,NO2的转化率为50%,设NO2的转化了x mol/L,
SO2(g) + NO2(g) = SO3(g) + NO(g)
始(mol/L) 0.15 0.1 0 0
转(mol/L) x x x x
平(mol/L) 0.15-x 0.1-x x x
则有:![]() ×100%=50%,解得x=0.05,
×100%=50%,解得x=0.05,
那么用SO3表示这段时间的反应速率v=![]() =
=![]() =0.025mol·L-1·min-1;
=0.025mol·L-1·min-1;
K=![]() =
=![]() =0.50;
=0.50;
SO2(g) + NO2(g) = SO3(g) + NO(g)
始(mol/L) 0.40 0.25 0.05 0.05
转(mol/L) y y y y
平(mol/L) 0.40-y 0.25-y 0.05+y 0.05+y
由于温度不变,平衡常数不发生变化,则有
K=![]() =
=![]() =0.50,解得y=0.125mol/L
=0.50,解得y=0.125mol/L
NO2的转化率=![]() ×100%=50%,转化率不变;
×100%=50%,转化率不变;
③温度为T2时,达到平衡的点为b点,T2前,温度升高,反应速率加快,NO2转哈氨氯增大,T2以后,该反应为放热反应,温度升高,平衡逆向移动,转化率减小。
(3)由数据可知,溶液中n(SO32-):n(HSO3-)=1:1时,溶液pH=7.2,且比值越大,溶液碱性越强,因此吸收液呈中性时,n(SO32-):n(HSO3-)<1:1,且中性时c(H+)=c(OH-),结合电荷守恒可得c(Na+)=2c(SO32-)+c(HSO3-),因此溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH

 阅读快车系列答案
阅读快车系列答案【题目】环境监测测定水中溶解氧的方法是:①量取25.00mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-
滴定次数 | 待测液的体积/mL | 0.1000mol·L-1 Na2S2O3的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
试回答:
(1)消耗Na2S2O3的体积平均值为___mL,水中溶解氧的量是(以g/L为单位,保留3位有效数字)___。
(2)滴定(I2和S2O32-反应)以淀粉溶液为指示剂,终点时现象为___。
(3)判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质___。
④待测液的滴定管之前有气泡,取液后无气泡___。