题目内容
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
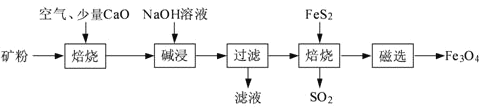
(1)粉碎高硫铝土矿石的目的是___。
(2)第一次焙烧时发生氧化还原反应:___。
(3)碱浸时发生反应的化学方程式为___。
(4)过滤后向滤液中通入过量的CO2气体,反应的离子方程式为___;___。
(5)“过滤”得到的滤渣中含有大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=___。
【答案】增大接触面积,加快反应速率 4FeS2+11O2![]() 2Fe2O3+8SO2 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3- AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
2Fe2O3+8SO2 Al2O3+2NaOH=2NaAlO2+H2O OH-+CO2=HCO3- AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 1:16
【解析】
高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)粉碎后通入空气、加入氧化钙焙烧,其中氧化钙和二氧化硫反应生成亚硫酸钙,和二氧化硅反应生成硅酸钙,得到产物加入氢氧化钠溶液碱浸其中氧化铝溶解生成偏铝酸钠溶液,经操作Ⅰ得到的固体中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2
(1)矿石粉碎可以增大固体和气体接触面积,加快反应速率。
(2)焙烧时发生氧化还原反应,第一次焙烧时发生氧化还原反应:4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,反应的化学方程式为:Al2O3+2NaOH=NaAlO2+H2O。
(4)向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3,反应的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,OH-+CO2=HCO3-。
(5)过滤”得到的滤渣中含大量的Fe2O3,Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,设有xmolFe3O4和ymolFeS2完全参加反应,根据电子得失守恒:2x×(3-8/3)=2y×5+y×(8/3-2),解得x/y=16,所以理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案