题目内容
X、Y、Z、W、Q均为含氮的化合物,在一定条件下,将发生如下转换关系(未配平):
①X→W+O2
②Z+Y+NaOH→H2O+W
③Y+SO2→Z+SO3
④Q+Y→Z+H2O
⑤X+Cu+H2SO4→Cu2++Y+SO42-
这五种化合物中氮元素的化合价由高到低的顺序为( )
①X→W+O2
②Z+Y+NaOH→H2O+W
③Y+SO2→Z+SO3
④Q+Y→Z+H2O
⑤X+Cu+H2SO4→Cu2++Y+SO42-
这五种化合物中氮元素的化合价由高到低的顺序为( )
| A、XYZWQ |
| B、XZYQW |
| C、XYWZQ |
| D、WXZQY |
考点:氮族元素简介
专题:氮族元素
分析:在氧化还原反应中,得电子的元素化合价降低,失电子的元素化合价升高,据此判断.
解答:
解:①X→W+O2中,X中氧元素失电子化合价升高,则N元素得电子化合价降低,所以N元素化合价X>W;
③Y+SO2→Z+SO3中,S元素失电子,则Y中N元素得电子,所以N元素化合价Y>Z;
②Z+Y+NaOH→H2O+W中,Y和Z发生氧化还原反应,则N元素化合价,W处于Z和Y中间,N元素化合价Y>W>Z;
④Q+Y→Z+H2O中,N元素化合价,Z处于Q和Y之间,已知Y>Z,所以Z>Q;
⑤X+Cu+H2SO4(浓)→Cu2++Y+SO42-,铜元素失电子,则X得电子生成Y,所以N元素化合价,X>Y;
所以这五种含氮化合物中氮元素的化合价由高到低的顺序为:X>Y>W>Z>Q,
故选C.
③Y+SO2→Z+SO3中,S元素失电子,则Y中N元素得电子,所以N元素化合价Y>Z;
②Z+Y+NaOH→H2O+W中,Y和Z发生氧化还原反应,则N元素化合价,W处于Z和Y中间,N元素化合价Y>W>Z;
④Q+Y→Z+H2O中,N元素化合价,Z处于Q和Y之间,已知Y>Z,所以Z>Q;
⑤X+Cu+H2SO4(浓)→Cu2++Y+SO42-,铜元素失电子,则X得电子生成Y,所以N元素化合价,X>Y;
所以这五种含氮化合物中氮元素的化合价由高到低的顺序为:X>Y>W>Z>Q,
故选C.
点评:本题考查化合价高低判断,根据得失电子与元素化合价的关系来分析解答即可,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
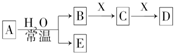 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )| A、若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32-,则E是一种清洁能源 |
| B、若D为CO,C能和E反应,则A一定为Na2O2 |
| C、若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应 |
| D、若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
下列有关电解质溶液中微粒浓度关系不正确的是( )
| A、0.1mol?L-1 pH=4的NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
| B、1mol?L-1的NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol?L-1 |
| C、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
等物质的量的下列离子可以大量共存且形成无色溶液的一组应该是( )
| A、Ag+、Cu2+、NO3-、Na+ |
| B、K+、Ba2+、Cl-、NO3- |
| C、Na+、Ca2+、Cl-、CO32- |
| D、Na+、Mg2+、NO3-、SO42- |
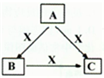 A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其它产物已略去),下列说法错误的是( )| A、若X为O2,则A可为硫化氢 |
| B、若X为KOH溶液,则A可能为AlCl3 |
| C、若X为Fe,则C可能为Fe(NO3)2 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X可能为Na |
已知:家用消毒液的主要成分是NaClO和NaCl,通常由氯气与氢氧化钠反应来制取.请判断下列反应需加入适当氧化剂才能实现的是( )
| A、Cl2→NaClO |
| B、MnO2→Mn2+ |
| C、SO2→SO32- |
| D、PCl3→PCl5 |
下列说法正确的是( )
| A、Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀消失 |
| B、将SO2气体通入Ba(OH)2溶液中没有白色沉淀生成 |
| C、将SO2气体通过BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成 |
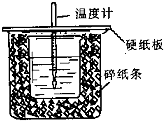 已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题:
已知中和热的定义为:稀溶液中酸和碱发生中和反应生成1mol水的反应热,某化学兴趣小组要完成中和热的测定实验,装置如图,回答下列问题: