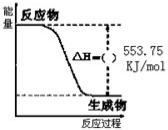
题目内容
下列有关电解质溶液中微粒浓度关系不正确的是( )
| A、0.1mol?L-1 pH=4的NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
| B、1mol?L-1的NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol?L-1 |
| C、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.0.1mol?L-1 pH=4的NaHA溶液,说明H2A为弱电解质,HA-的电离程度大于HA-的水解程度,据此判断溶液中各离子浓度关系;
B.根据1mol?L-1的NaHCO3溶液中的物料守恒进行判断;
C.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+);
D.根据物料守恒可知,混合液中2c(Na+)=c(HX)+c(X-),所以不可能存在c(Na+)>c(HX)>c(X-)的关系.
B.根据1mol?L-1的NaHCO3溶液中的物料守恒进行判断;
C.溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+);
D.根据物料守恒可知,混合液中2c(Na+)=c(HX)+c(X-),所以不可能存在c(Na+)>c(HX)>c(X-)的关系.
解答:
解:A.0.1mol?L-1 NaHA溶液的pH=4,说明H2A为弱酸,HA-的电离程度大于HA-的水解程度,则溶液中c(A2-)>c(H2A),由于HA-只是部分水解,则c(HA-),则溶液中离子浓度关系为:c(HA-)>c(A2-)>c(H2A),故A正确;
B.1mol?L-1的NaHCO3溶液中,根据物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+)=1mol?L-1,故B正确;
C.常温下,pH=7的NH4Cl与氨水的混合溶液中,溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),则溶液中离子浓度大小关系为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故C正确;
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中,由物料守恒可知:2c(Na+)=c(HX)+c(X-),若该混合溶液以电离为主,则c(X-)>c(Na+)>c(HX),若该溶液以水解为主,则c(HX)>c(Na+)>c(X-),c(Na+)会处于三者的中间位置,不可能存在c(Na+)>c(HX)>c(X-),故D错误;
故选D.
B.1mol?L-1的NaHCO3溶液中,根据物料守恒可知:c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+)=1mol?L-1,故B正确;
C.常温下,pH=7的NH4Cl与氨水的混合溶液中,溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),则溶液中离子浓度大小关系为:c(Cl-)=c(NH4+)>c(H+)=c(OH-),故C正确;
D.等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中,由物料守恒可知:2c(Na+)=c(HX)+c(X-),若该混合溶液以电离为主,则c(X-)>c(Na+)>c(HX),若该溶液以水解为主,则c(HX)>c(Na+)>c(X-),c(Na+)会处于三者的中间位置,不可能存在c(Na+)>c(HX)>c(X-),故D错误;
故选D.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中离子浓度大小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
据报道,火星和金星大气层中可能存在一种非常特殊的气态化合物.这种化合物会导致温室效应,它的结构式为16O=C=18O.则16O=C=18O( )
| A、与16O=C=16O互为同素异形体 |
| B、与18O=C=18O有几乎相同的化学性质 |
| C、与Na216O2反应生成的氧气中含有18O |
| D、与等质量的16O=C=16O和18O=C=18O混合气体含有相同的原子个数 |
用如图装置实验,下列叙述不正确的是( )
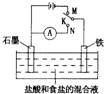

| A、K与N连接时,组成原电池装置 |
| B、K与N连接时,石墨电极产生气泡 |
| C、K与M连接时,一段时间后溶液的pH减小 |
| D、K与M连接时,石墨电极的反应为:2Cl--2e-═Cl2↑ |
能大量共存的一组离子是( )
| A、K+、Ca2+、Cl-、NO3- |
| B、H+、Na+、Fe2+、MnO4- |
| C、Na+、H+、SO42-、ClO- |
| D、K+、AlO2-、Cl-、HCO3- |
将Al片和Cu片用导线相连,一组插入稀H2SO4溶液中,一组插入浓NaOH溶液中,分别形成了原电池.则在这两个原电池中( )
| A、Al片均作阴极 |
| B、电解质溶液的pH均逐渐升高 |
| C、Cu片上均有气泡放出 |
| D、电路中流过等物质的量的电子时,放出等体积的气体 |
某二种气态混合烃1L,完全燃烧后生成1.4L CO2和1.6L水蒸气(体积均在相同条件下测得),该混合烃是( )
| A、乙烷、乙炔 |
| B、甲烷、乙炔 |
| C、甲烷、丙炔 |
| D、乙烷、丙炔 |
下列反应的离子方程式正确的是( )
| A、NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
| C、氧化铜溶于浓硝酸:CuO+2H+=Cu2++2H2O |
| D、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |