题目内容
【题目】(1)![]() 世纪
世纪![]() 年代,
年代,![]() 和
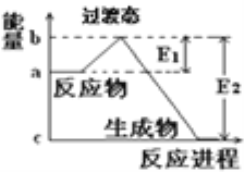
和![]() 在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是
在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,
过程中的能量变化示意图,说明这个反应是________(填“吸热”或“放热”)反应,![]() 和
和![]() 的总能量________(填“
的总能量________(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)![]() 和
和![]() 的总能量.
的总能量.
(2)在某体积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]()
![]()
![]() ,
,![]() 时,测得容器中
时,测得容器中![]() 的物质的量为
的物质的量为![]() ,则:
,则:
①该段时间内,用![]() 表示的平均反应速率为________.
表示的平均反应速率为________.
②假设此反应在![]() 时达到平衡,则此时容器内气体的总物质的量为________.
时达到平衡,则此时容器内气体的总物质的量为________.
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是________
A.容器内气体的质量保持变
B.NO2的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.NO2的消耗速率与![]() 的消耗速率相等
的消耗速率相等
E.容器内气体的物质的量保持不变.
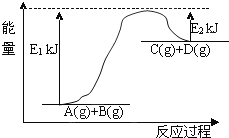
(3)已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
该反应是________反应,该反应的△H=________,1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量________.
【答案】放热 > 0.05mol/(L.min) 1.5mol BD 吸热 (E1E2)KJ/mol 低
【解析】
(1)当反应物的总能量高于生成物的总能量时,反应为放热反应;
(2)①根据公式v=![]() 进行计算;
进行计算;
②反应是一个前后体积不变的反应,所以反应后容器内气体的总物质的量=反应前的气体的总物质的量;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据平均相对分子质量的公式进行分析;
(3)根据反应物总能量和生成物总能量的关系判断反应热。
(1)当反应物的总能量高于生成物的总能量时,反应为放热反应;
(2)① NO2(g) + CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
初始浓度: 0.25 0.25 0 0
变化浓度: 0.1 0.1 0.1 0.1
2min时浓度:0.15 0.15 0.1 0.1
用CO2表示的平均反应速率v=![]() =
=![]() =0.05molL-1min-1;
=0.05molL-1min-1;
②反应是一个前后体积不变的反应,所以反应在5min时达到平衡,则此时容器内气体的总物质的量=反应前的气体的总物质的量=1.5mol;
③A.容器内的气体反应前后遵循质量守恒,容器内气体的质量保持不变,不一定是平衡状态,故A错误;
B.NO2的物质的量浓度不再改变是平衡状态,故B正确;
C.容器内气体的平均相对分子质量在数值上=![]() ,始终是一个不变量,所以容器内气体的平均相对分子质量不变时,不一定是平衡状态,故C错误;
,始终是一个不变量,所以容器内气体的平均相对分子质量不变时,不一定是平衡状态,故C错误;
D.NO2的消耗速率与CO2的消耗速率相等,说明正逆反应速率相等,是平衡状态,故D正确;
E.反应是一个前后体积不变的反应,容器内气体的物质的量保持不变,不一定是平衡状态,故E错误;
故答案为BD;
(3)反应物总能量大于生成物总能量,反应后能量升高,所以是吸热反应;反应热=反应物总能量-生成物总能量,即△H=E1-E2;1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量一定低。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】Ⅰ.在![]() 密闭容器中放入
密闭容器中放入![]() ,在一定温度进行如下反应:
,在一定温度进行如下反应:![]()
容器内气体总压强(P)与起始压强![]() 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
时间 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题
(1)下列能提高A的转化率的是_______
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体![]() ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍
(2)该反应的平衡常数的表达式K_______,前2小时C的反应速率是_________![]() ;
;
(3)平衡时A的转化率___________,C的体积分数__________(均保留两位有效数字)
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围![]() ______
______![]()
Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将![]() 溶于水配成
溶于水配成![]() 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的![]() 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数![]() ___________
___________