题目内容
14.(1)有:①168O、178O、188O ②H2、D2、T2 ③石墨、金刚石 ④11H、21H、31H四组微粒或物质,其中互为同位素的是①④(用序号回答).(2)36gH2O和60gD2O的物质的量之比为2:3;中子个数之比为8:15;分别与足量的钠反应,产生气体的质量比为1:3.
(3)RO3n-共有x个电子,R原子的质量数为A,则R原子的中子数是A+n+24-x.
分析 (1)具有相同质子数,不同的中子数的核素互称同位素;
(2)根据n=$\frac{m}{M}$计算H2O和D2O的物质的量,再利用分子的构成、原子的构成来计算中子数之比;D2O和H2O分别与足量的金属钠反应,有2Na~H2↑,以此来计算氢气的气体体积之比及质量之比;
(3)中子数=质量数-质子数,阴离子核外电子数=质子数+所带电荷数.
解答 解:(1)①168O、178O、188O、④11H、21H、31H的质子数相同,中子数不同,故互为同位素,故答案为:①④;
(2)36g H2O的物质的量n(H2O)=$\frac{36g}{18g/mol}$=2mol,80g D2O的物质的量n(D2O)=$\frac{60g}{20g/mol}$=3mol,
则它们的物质的量之比为2mol:3mol=2:3,所含的中子数之比为2mol×8:3mol×(1×2+8)=8:15,分别与足量的金属钠反应,由2Na~2D2O~D2↑,2Na~2H2O~H2↑,则放出的氢气的物质的量之比为:2mol:3mol=2:3,同条件下,体积比等于物质的量之比,所以气体体积之比为2mol:3mol=2:3,放出气体的物质的量之比是2:3,放出气体的质量之比是2mol×2g/mol:3mol×4g/mol=1:3,故答案为:2:3;8:15;1:3;
(3)R原子的质量数为A,设R原子核内含中子的数目为N,则R的质子数为A-N,离子RO3n-中共有x个核外电子,所以A-N+24+n=x,所以R原子核内含中子的数目N=A+n+24-x,故答案为:A+n+24-x.
点评 本题考查中子数、质量数、质子数之间的关系以及离子核外电子数、质子数、电荷数之间的关系以及物质的量的计算,明确质量、物质的量的关系,H、D的原子构成及Na与水的反应是解答本题的关键,题目难度中等.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案(1)盛装0.2000mol/L盐酸标准液应该用酸式滴定管.
(2)当接近滴定终点时,很少量的碱或酸就会引起溶液的pH发生突变.
(3)有关数据记录如下:
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.20 |
(4)若只用蒸馏水冲洗锥形瓶,则测定结果无影响(填“无影响”、“偏高”或“偏低”).
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是偏高.
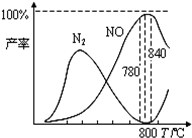 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下①主反应和
②副反应:
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
有关物质产率与温度的关系如图.下列说法正确的是( )
| A. | 加压可提高NH3生成NO的转化率 | |
| B. | 工业上氨催化氧化生成 NO时,反应温度最好控制在780℃以下 | |
| C. | 达到平衡后,保持其它条件不变,再充入2 mol O2反应①的平衡常数K保持不变 | |
| D. | N2氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g)△H=+363 kJ/mol |
| A. | 粗铜提纯时以硫酸铜溶液作电解液,精铜作阳极 | |
| B. | 铁钉镀铜时铁钉做阴极,发生氧化反应 | |
| C. | 用惰性电极电解CuSO4溶液一段时间后再加入纯净的CuO,可以使溶液恢复到原来的成分和浓度 | |
| D. | 粗铜提纯时电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
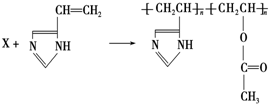
| A. | 醇 | B. | 烷烃 | C. | 烯烃 | D. | 酯 |
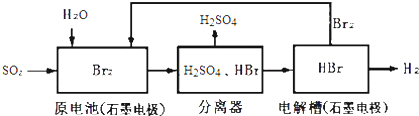
(1)根据资料:
| 化学式 | Ag2SO4 | AgBr | AgCl |
| Ksp | 1.4×10-5 | 5.0×10-13 | 1.8×10-10 |
(2)表示该工艺流程的总反应化学方程式为:SO2+2H2O=H2SO4+H2;该生产工艺的优点有溴可以循环利用,获得清洁能源氢气(答一点即可).
(3)某含有大量氯化银沉淀的悬浊液中c(Cl-)=0.36mol•L-1,加入等体积的溴化钠溶液,若要产生溴化银沉淀,加入的溴化钠溶液的最小浓度是10-3mol•L-1.
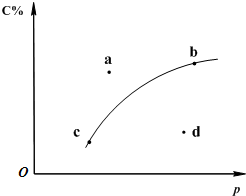 对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题:
对于可逆反应2A(?)+B(g)?2C(g);如图是其它条件一定时反应中C的百分含量与压强的关系曲线.回答下列问题: .(在答题纸上标)
.(在答题纸上标)