题目内容
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.12.5mL 16mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C.1L 1 mol·L-1的醋酸溶液中离子总数为2NA |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA |
D
解析试题分析:A、随着反应进行,硫酸的浓度逐渐减小,变为稀硫酸后,反应改变,先后发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,转移电子数大于0.2NA,错误;B、0.1 mol24Mg18O晶体中所含中子总数为:0.1×(12+10)NA="2.2" NA,错误;C、醋酸为弱酸,所以1L 1 mol·L-1的醋酸溶液中离子总数小于2NA,错误;D、每个Si原子形成4个硅氧键,所以4.5 g SiO2晶体中含有的硅氧键数目为:4.5g÷60g/mol×4 NAmol-1="0.3" NA,正确。
考点:本题考查阿伏伽德罗常数的应用。

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列各溶液中NO3-物质的量浓度最大的是
| A.20 mL 2 moL/L Mg(NO3)2 | B.100 mL 2.5 mot/L NaNO3 |
| C.25 mL 1.0mol/L Al(NO3)3 | D.30 mL 2.5 mol/L NH4NO3 |
用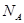 表示阿伏加德罗常数的值。下列叙述中不正确的是
表示阿伏加德罗常数的值。下列叙述中不正确的是
A.足量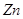 与一定量的浓硫酸反应,产生 与一定量的浓硫酸反应,产生 (标况)气体时,转移的电子数为 (标况)气体时,转移的电子数为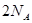 |
B.一定条件下,32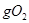 和足量的铁粉充分反应,转移的电子数为 和足量的铁粉充分反应,转移的电子数为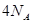 |
C.4.6g乙醇和甲酸(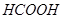 )的混合物中含有的碳原子数在 )的混合物中含有的碳原子数在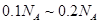 之间 之间 |
D.分子总数为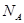 的NO和 的NO和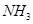 混合气体中含有的氮原子数为 混合气体中含有的氮原子数为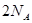 |
用nA表示阿伏加德罗常数的数值,下列叙述正确的是
| A.常温常压下,200 g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B.标准状况下,22.4LCHCI3中含C -H键数目为nA |
| C.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
下列物质的电子式书写正确的是
A.N2: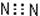 |
B.CO2: |
C.Na2O: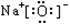 |
D.HCl: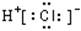 |
下列关于物质的量浓度表述正确的是
| A.0.2 mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6 mol |
| B.50mL 2 mol·L-1的NaCl溶液和100mL 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等 |
| C.用1 L水吸收22.4 L氯化氢(标况下)所得盐酸的浓度是1 mol·L-1 |
| D.10 g 98%的硫酸(密度为1.84g · cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.分子数为NA的CO、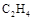 混合气体体积约为22.4L,质量为28g 混合气体体积约为22.4L,质量为28g |
| B.常温常压下,92g的NO2和N2O4混合气体含有的原子数为4NA |
| C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA |
D.78g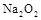 固体与H2O完全反应转移的电子数为NA 固体与H2O完全反应转移的电子数为NA |
实验室用NaCl固体配400 mL 1.0 mol/L NaCl溶液,下列判断不对的是( )
| A.用托盘天平称取NaCl固体23.4 g |
| B.应选用500 mL的容量瓶来配制此溶液 |
| C.在转移操作中不慎将溶液洒到容量瓶外面,应该重新配置溶液 |
| D.加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
同温同压下,两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内气体一定具有相同的( )
| A.质量 | B.原子总数 | C.碳原子数 | D.密度 |