题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.分子数为NA的CO、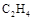 混合气体体积约为22.4L,质量为28g 混合气体体积约为22.4L,质量为28g |
| B.常温常压下,92g的NO2和N2O4混合气体含有的原子数为4NA |
| C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA |
D.78g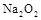 固体与H2O完全反应转移的电子数为NA 固体与H2O完全反应转移的电子数为NA |
D
解析试题分析:A、没有指明标准状况下,错误;B、因为NO2和N2O4的最简式相同,所以92g的NO2和N2O4混合气体含有的原子:92g÷56g/mol×3=6mol,即6NA,错误;C、乙烯与丙烯的最简式都是CH2,所以7.0g乙烯与丙烯的混合物中含有氢原子:7.0g÷14g/mol×2=1mol,即NA,错误;D、Na2O2固体与电子的对应关系为:Na2O2 ~ e-,所以电子为:78g÷78g/mol=1mol,即NA,正确。
考点:本题考查阿伏伽德罗常数的应用。

练习册系列答案
相关题目
设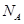 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,4g CH4含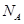 个共价键 个共价键 |
B.常温常压下,22.4L氦气含有的原子数为2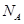 |
C.1molS在足量O2中燃烧,转移的电子数为6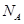 |
D.0.1 mol/L的碳酸氢钠溶液中含钠离子数为0.1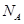 。 。 |
设NA为阿佛加德罗常数,下列叙述正确的( )
| A.标准状况下,NA个SO3分子所占的体积约为22.4 L |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.铁粉与一定量的浓硫酸反应,若产生11.2 L SO2和1 g H2,铁粉失去的电子数为2NA |
| D.50 mL 12 mol?L-1浓盐酸与足量二氧化锰反应,转移电子数为0.3 NA |
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.12.5mL 16mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C.1L 1 mol·L-1的醋酸溶液中离子总数为2NA |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA |
等体积的硫酸钠、硫酸镁、硫酸铝溶液分别于足量氯化钡溶液反应,若生成硫酸钡的质量相等,则三种硫酸盐的物质的量浓度之比为
| A.3:3:1 | B.6:3:2 | C.3:2:1 | D.1:1:1 |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.常温常压下,17g甲基(—14CH3)所含的中子数为9NA |
| B.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA |
| C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| D.5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为( )
| A.1:2:3 | B.1:6:9 | C.1:3:3 | D.1:3:6 |
碱式碳酸镁的化学式为a Mg(OH)2 ·b MgCO3·c H2O。取4.66 g碱式碳酸镁,高温煅烧至恒重,得到固体2.00g和标准状况下0.896L CO2。该碱式碳酸镁b : c的值为
| A.1 :1 | B.5 :4 | C.4 :5 | D.1 :4 |
能正确表示下列反应的化学方程式是
A.黄铁矿煅烧:2FeS2+5O2  2FeO+4SO2 2FeO+4SO2 |
B.石英与石灰石共熔:SiO2+CaO CaSiO3 CaSiO3 |
C.氨的催化氧化:4NH3+5O2  4NO+6H2O 4NO+6H2O |
| D.氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl3+CaClO2+2H2O |