题目内容
【题目】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______,原因是__________________________________________。
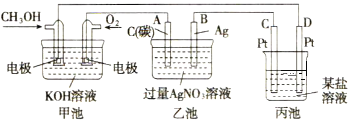
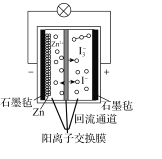
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________,若改用O2来氧化,则68g的H2O2相当于O2的质量为____;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________。
【答案】不可 HNO3具有强氧化性,会氧化Fe2+ 4H2O+2NO2+8e-=N2+8OH- 45.3g NH3极易溶于水,导致消耗NH3变多 2NaOH+2NO2=NaNO3+NaNO2+H2O +3 NO2-+H2O2=NO3-+H2O 32.0g 还原产物为水,无污染
【解析】
(1)Fe2+具有强还原性,酸性环境下NO3-具有强氧化性,二者会发生氧化还原反应,故不可加硝酸抑制Fe2+水解;
故答案为:不可;HNO3具有强氧化性,会氧化Fe2+;
(2)消除NO2的污染将其转化为N2即可,NO2中N元素降低4价,得到N2,用OH-保证电荷守恒,用水保证H和O的原子守恒,即可配平。根据转移电子守恒NH3-3e-,故n(NH3)=![]() mol,m(NH3)=
mol,m(NH3)=![]() mol×17g/mol≈45.3g;1体积水能溶解700体积氨气,故反应过程中肯定有些溶于水,而导致损失。
mol×17g/mol≈45.3g;1体积水能溶解700体积氨气,故反应过程中肯定有些溶于水,而导致损失。
故答案为:4H2O+2NO2+8e-=N2+8OH- ; 45.3g ; NH3极易溶于水,导致消耗NH3变多;
(3)NaOH溶液吸收NO2,导致N元素发生歧化反应,得到NaNO3和NaNO2;
故答案为:2NaOH+2NO2=NaNO3+NaNO2+H2O;
(4)NaNO2中N元素为+3价,为消除其毒性可将其氧化为NO3-,产物可用作化肥;68g的H2O2(即2mol)转移4mol电子,1mol的O2也是转移4mol电子,故相当于O2质量为32g。H2O2被称为绿色氧化剂,因其还原产物为H2O,无污染。
故答案为: +3; NO2-+H2O2=NO3-+H2O ;32.0g ; 还原产物为水,无污染。

【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
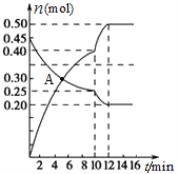
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】以低品位红土镍矿(主要成分可表示为![]() 、
、![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]() 、
、![]() )为原料制备纳米级
)为原料制备纳米级![]() 的工艺流程如下:
的工艺流程如下:

已知氢氧化物的参数如下表:
氢氧化物 | 溶度积 | 开始沉淀 | 完全沉淀 |
|
| 4.1 | 5.5 |
|
| 2.2 | 3.5 |
|
| 6.7 | 9.5 |
|
| 9.4 | 12.4 |
回答下列问题:
(1)“滤渣Ⅰ”的主要成分是______(填化学式)。
(2)常温下,调![]() 的目的是______。当
的目的是______。当![]() 时,溶液中
时,溶液中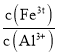 =______
=______
(3)写出“除铜镍”过程发生反应的离子方程式为![]() 、______________。“除钙”过程反应温度不宜超过
、______________。“除钙”过程反应温度不宜超过![]() 的原因_________________________。
的原因_________________________。
(4)“滤液”中溶质的主要成分为________________,获取该物质晶体的具体实验操作为__________。