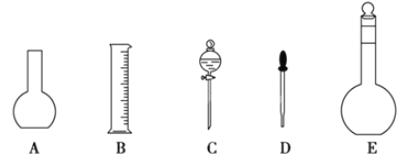
题目内容
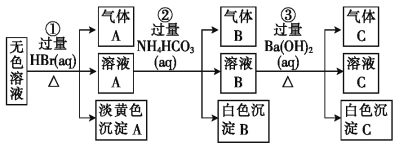
【题目】某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、CO32-、S2-、SO32-、SO42-。现取该溶液进行有关实验,实验过程及现象如图所示:
下列说法不正确的是
A.根据实验①中的现象可推出,淡黄色沉淀一定不是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有AlO2-
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
【答案】D
【解析】
由于无色溶液与过量溴化氢反应生成了气体A和淡黄色沉淀A,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体A,所以淡黄色沉淀为单质硫,是硫化氢与二氧化硫反应生成的,溶液中一定存在硫离子和亚硫酸根离子,一定不会存在Ag+、Ba2+、Al3+,溶液A中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体B为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子,溶液B与过量氢氧化钡溶液反应,生成的气体C为氨气,白色沉淀为碳酸钡或硫酸钡,所以溶液中一定存在的离子有:Na+、S2-、SO32-、AlO2-;一定不存在的离子为:Ag+、Ba2+、Al3+;可能存在的离子为:CO32-、SO42-;
A.实验①中由于无色溶液与过量溴化氢反应生成了气体A和淡黄色沉淀A,沉淀若是溴化银,则不存在S2-、CO32-、SO32-,就不可能生成气体A,所以淡黄色沉淀一定不是AgBr,A选项正确;
B.溶液A中含有过量的溴化氢,与过量的碳酸氢铵反应,生成的气体B为二氧化碳,白色沉淀只能为氢氧化铝,说明原溶液中一定含有偏铝酸根离子,B选项正确;
C.溶液B与过量氢氧化钡溶液反应,生成的气体C为氨气,白色沉淀C中一定含有过量的碳酸氢铵与氢氧化钡反应生成的碳酸钡沉淀,可能含有原溶液中的硫酸根离子与钡离子生成的硫酸钡沉淀,C选项正确;
D.根据上述分析,溶液中肯定含有Na+、S2-、SO32-、AlO2-,不能确定是否含有CO32-、SO42-,D选项错误;
答案选D。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案