题目内容
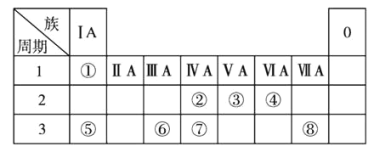
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)= ]。下列说法正确的是( )
]。下列说法正确的是( )
A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
【答案】C
【解析】
A.溶液中存在H2FeO4,说明H2FeO4在溶液中存在电离平衡,则H2FeO4属于弱电解质,故A错误;
B.结合图象可知,c(H2FeO4)=c(H3FeO4+)时,溶液的pH<2,c(H+)>0.01mol/L,则H2FeO4+H+H3FeO4+的平衡常数K=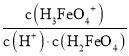 =
=![]() <
<![]() =100,即K<100,故B错误;
=100,即K<100,故B错误;
C.B点pH=4,δ(HFeO4-)=0.806,则δ(H2FeO4)≈0.194,由于溶液体积相同,则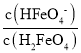 =
=![]() ≈4.15,则H2FeO4的第一步电离常数Ka1=
≈4.15,则H2FeO4的第一步电离常数Ka1=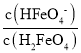 ×c(H+)=4.15×1×10-4=4.15×10-4,故C正确;
×c(H+)=4.15×1×10-4=4.15×10-4,故C正确;
D.FeO42-水解促进了水的电离,c(FeO42-)的浓度浓度越大,则水的电离程度越大,根据图象可知,水的电离程度:C>A,故D错误;
答案选C。

【题目】某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为_________g。 |
(2)称量Na2CO3固体 | 称量过程中主要用到的仪器是_____ |
(3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是___ |
(4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________________________________________________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______ |
(6)你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol·L-1,请说明理由。________
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
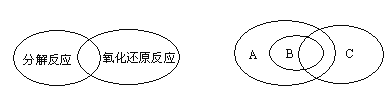
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |