题目内容
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
【答案】三颈烧瓶 除去Cl2中混有的HCl杂质 FCB 将装置内的氯气排入D内吸收以免污染空气,并将B中残留的S2Cl2排入E中收集 滴入浓盐酸的速率(或B中通入氯气的量) 2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑ 不可行 二氧化硫被硝酸氧化成硫酸根,既难于检验二氧化硫又干扰氯化氢检验 ac ![]() ×100%
×100%
【解析】
(1)实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2,利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入;
①仪器m的作用和形状分析仪器名称为三颈烧瓶;
②利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入,结合上述分析连接装置;
③实验前打开K1,通入一段时间的氮气排尽装置内空气,是排净装置内空气,实验结束停止加热后,再通入一段时间的氮气,是把生成的S2Cl2排入E中收集;
④氯气过量则会生成SCl2,温度过高分解,实验的关键是控制好温度和滴入浓盐酸的速率或B中通入氯气的量;
(2) ①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,该气体X为SO2,且反应过程中只有一种元素化合价发生变化,即反应中只有硫元素化合价发生变化,产生烟雾,雾应为反应产生的氯化氢气体在空气中与水蒸汽结合形成的液滴,根据得失电子守恒,书写化学方程式;
②甲同学为了验证两种气体产物,二氧化硫被硝酸氧化成硫酸根,与银离子结合形成硫酸银,既难于检验二氧化硫又干扰氯化氢检验,该方案不可行;
(3) S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数,混合气体通过溶液W溶液吸收二氧化硫气体得到溶液中加入过量氢氧化钡溶液反应得到硫酸钡沉淀,过滤洗涤干燥称量得到硫酸钡沉淀质量mg,元素守恒计算二氧化硫体积分数。
(1)实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2,利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入
①仪器m 的名称为三颈烧瓶,装置F中试剂的作用是:除去Cl2中混有的HCl杂质,
故答案为:三颈烧瓶;除去Cl2中混有的HCl杂质;
②利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入,依据上述分析可知装置连接顺序为:A→F→C→B→E→D,
故答案为:FCB;
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是:将装置内的氯气排入D内吸收以免污染空气,并将B中残留的S2Cl2排入E中收集,
故答案为:将装置内的氯气排入D内吸收以免污染空气,并将B中残留的S2Cl2排入E中收集;
④反应生成S2Cl2的氯气过量则会生成SCl2,温度过高S2Cl2会分解,为了提高S2Cl2的纯度,实验的关键是控制好温度和滴入浓盐酸的速率或B中通入氯气的量,
故答案为:滴入浓盐酸的速率或B中通人氯气的量;
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,该气体X为SO2,且反应过程中只有一种元素化合价发生变化,即反应中只有硫元素化合价发生变化,产生烟雾,雾应为反应产生的氯化氢气体在空气中与水蒸汽结合形成的液滴,根据得失电子守恒,该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑,
故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑;
②甲同学为了验证两种气体产物,二氧化硫被硝酸氧化成硫酸根,与银离子结合形成硫酸银,既难于检验二氧化硫又干扰氯化氢检验,该方案不可行,
答案为:不可行;二氧化硫被硝酸氧化成硫酸根,既难于检验二氧化硫又干扰氯化氢检验;
(3) S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数,混合气体通过溶液W溶液吸收二氧化硫气体得到溶液中加入加入过量氢氧化钡溶液反应得到硫酸钡沉淀,过滤洗涤干燥称量得到硫酸钡沉淀质量mg,元素守恒计算二氧化硫体积分数,
①W溶液是吸收氧化二氧化硫的溶液,可以是a;H2O2溶液,c.氯水,但不能是b;KMnO4溶液(硫酸酸化),因为高锰酸钾溶液能氧化氯化氢生成氯气,应选ac,
故答案为:ac;
②过程分析可知生成沉淀为硫酸钡沉淀,硫元素守恒得到二氧化硫物质的量n(SO2)=n(BaSO4)=![]() =
=![]() mol,该混合气体中二氧化硫的体积分数为气体物质的量分数,二氧化硫体积分数=
mol,该混合气体中二氧化硫的体积分数为气体物质的量分数,二氧化硫体积分数=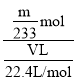 ×100%=
×100%=![]() ×100%,
×100%,
故答案为:![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案