��Ŀ����
��1����ͼ��ʾ��A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ������ҡ��ر�K2������1 mol NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱA��B�������ͬ��Ϊa L��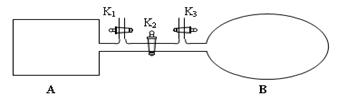
��B�п�ͨ��________________�жϿ��淴Ӧ2NO2 N2O4�Ѿ��ﵽƽ�⡣
N2O4�Ѿ��ﵽƽ�⡣
����ƽ�����A�������ٳ���0.5mol N2O4�������µ���ƽ���ƽ��������NO2���������_______________���� �������С�����䡱����
��������A�е���ƽ������ʱ��t s���ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������ƽ����ѧ��Ӧ����v(NO2)����____________________��
������K2��ƽ���B�������������0.4a L�����K2֮ǰ������B���Ϊ______L��
��2���õ��ķ�����������Һ����Ϊ��������о�������Ҫ��ʵ�����壬������ת��Ϊ�������ǵ�ⷨ�������������һ����Ҫ���ݡ�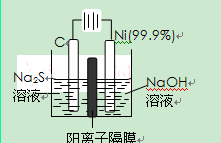
��ͼ���ǵ������������ʵ��װ�ã�
����֪�����ķ�ӦΪ��(x+1)S2��=SxS2��+2xe����
�������ĵ缫��Ӧʽ�ǣ� ��
����Ӧת��xmol����ʱ���������������Ϊ ����״���£���
�ڽ�Na2S��9H2O����ˮ������������Һʱ��ͨ������
�����������ܽ⡣��ԭ���ǣ������ӷ�Ӧ����ʽ��ʾ���� ��
��14�֣�ÿ��2�֣�
��1���������Ҳ��ٱ�С����ɫ���ٱ仯
�ڱ�С
��0.4/at(mol.L-1.s-1)
��0.7a
��2����2H+ + 2e��=H2���� 11.2x L
��2S2����O2��2H2O=2S����4OH��
���������������1�������Ҳ��ٱ�С����ɫ���ٱ仯ʱ����ʾ�����ʵ�Ũ�Ȳ��䣬����Ӧ�Ѵﵽƽ�⡣
����ƽ�����A�������ٳ���0.5mol N2O4��������ѹǿ��������ѹǿƽ�����������ʵ�����С�ķ����ƶ�������ƽ��������NO2�����������С��
����������ʽ���м��㣺��ת����NO2�����ʵ���Ϊx��2NO2 N2O4
N2O4
��ʼ���ʵ�����mol�� 1 0
ת�����ʵ�����mol�� x x/2
ƽ�����ʵ�����mol�� 1-x x/2
�ﵽƽ���������ѹǿΪ��ʼѹǿ��0.8������1-x+x/2����1="0.8" ��x=0..4mol����V(NO2)=0.4mol��aL��ts=0.4/at(mol.L-1.s-1)��
�ܴ�K2�����൱�����ڵ��µ�ѹʱ��ƽ�⣬���ƽ���ǵ�Ч�ģ����ڴ�ʱ��Ӧ������ʵ�����B�еĶ��������Դ�K2֮ǰ������B���Ϊ��aL+0.4aL����2=0.7aL��
��2����NaOH��Һ��H2O�������H+�������Ϸŵ磺2H+ + 2e��=H2�������ݻ��ϼ۵ı仯��֪��H2����ӵĶ�Ӧ��ϵΪ��H2 �� 2e?��V(H2)=xmol��1/2��22.4L/mol=11.2x L��
���ڵ����������ܽ�ɷ�ֹS2?��O2����������ֹ2S2����O2��2H2O=2S����4OH�� ������
���㣺���⿼�黯ѧƽ����жϡ���ѧƽ���ƶ�����Ӧ���ʺ�ƽ��ļ��㡢�缫����ʽ����д�����㡢���ӷ���ʽ����д��

 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д���ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����ᴿ�����ٵķ�Ӧԭ��ΪW(s)��I2(g) WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��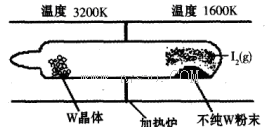
�ٷ�Ӧ(I)��ƽ�ⳣ������ʽK��_______����K��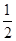 ����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
�ڷ�Ӧ(I)�ġ�H____0���������������������Ӧ��ϵ�п�ѭ��ʹ�õ�������_________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����_________������ţ���
a��I2��WI2��Ũ�����
b��W���������ٱ仯
c�������ڻ��������ܶȱ��ֲ���
d����λʱ���ڣ����������ĵ����ʵ�����⻯�����ɵ����ʵ������
��2��25��ʱ��NaHSO3��ˮ��ƽ�ⳣ����1.0��10��12mol/L������¶���H2SO3 HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��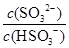 ��________�����������С�����䡱����
��________�����������С�����䡱����
��3��ֱ���ŷź�SO2���������γ����꣬Σ����������Na2SO3��Һ����SO2�Ĺ����У�pH��n��SO32������n(HSO3��)�仯��ϵ���±���
| n(SO32��): n ( HSO3��) | 91:9 | 1:1 | 1:91 |
| pH(25��) | 8.2 | 7.2 | 6.2 |
������Һ������ʱ����Һ������Ũ���ɴ�С��˳��Ϊ_________________________��
��һ��������ܱ������У����л�ѧ��ӦCO2 (g)+H2 (g) CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t / �� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=____________��
��2������ӦΪ________��Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������________����ѡ�۷֣���
A��������ѹǿ���� B�����������c (CO)����
C��v��(H2)=v��(H2O) D��c (CO2)="c" (CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c (CO2)��c (H2)="c" (CO)��c (H2O)�����жϴ�ʱ���¶�Ϊ________�档
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
����ͼװ����ʾ��A��B�еĵ缫Ϊ��Ķ��Ե缫��C��DΪ���ڽ���Na2SO4��Һ����ֽ���ϵIJ��У���Դ��a��b��������A��B�г���KOH��Һ������KOH��Һ��ˮ���С��ж�K1���պ�K2��K3ֱͨ���硣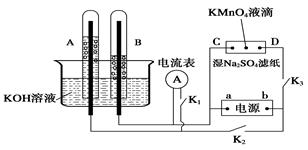
�ش��������⣺
��1�� a�ǵ�Դ�� ����д��A�еĵ缫��ӦʽΪ_____��
��2��ʪ��Na2SO4��ֽ�����ܹ۲쵽��������____________��
��3�����һ��ʱ���A��B�о��������Χ�缫������ʱ�ж�K2��K3���պ�K1�����ֵ�������ָ���ƶ���д����ʱB�еĵ缫��ӦʽΪ ��
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״���CO(g)��2H2(g)  CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)����ش��������⣺
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)����ش��������⣺
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��4���ɱ��������жϦ�H 0�����������������������
��5�������������䣬ֻ�ı�����һ�����������д�ʩ����״����ʵ��� ��
A�������¶ȣ�B��ʹ�ú��ʵĴ�����C����С�������ݻ���D�����������H2��E����ѹʱ������He��F������ϵ�з����CH3OH
��6��ij�¶��£���2mol CO��6 mol H2����2L�ܱ������У���Ӧ���е�4minĩ�ﵽƽ�⣬��ʱ���c(CO) ��0.2 mol/L ����0~4min��H2�ķ�Ӧ����Ϊ ���������¶��ݻ������������г���һ������CH3OH�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ����������CH3OH��������� ����������С�������䡱����
��¯���������з�������Ҫ��ӦΪ1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK=_____________����H________0(�>������<����=��)��
��2����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1��0 mol����Ӧ����l0 min�ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʦ�(CO2)=" _________" ��CO��ƽ��ת����= _____________��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_____________��
| A������Fe���� |
| B������Fe203���� |
| C���Ƴ�����CO2 |
| D����߷�Ӧ�¶� |
F��������ʵĴ���
�α���ͨ������ᣨH2C2O4����Һ�еμ��������ữ����������о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬����д���÷�Ӧ�Ļ�ѧ����ʽ ���÷�Ӧ����ʹ��ָʾ����ԭ���� ��
��ijͬѧ���ݿα���������Ի�ѧ��Ӧ���ʵ�Ӱ��ԭ�����������������������ᷴӦ�й�ʵ�飬ʵ����̵����ݼ�¼���£����������ϱ�����Ϣ���ش��й����⣺
| ʵ�� ��� | ��Ӧ�¶� ���棩 | �μӷ�Ӧ������ | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0��1 | 10 | 0��1 | 0 |
| B | 20 | 5 | 0��1 | 10 | 0��1 | 5 |
| C | 20 | 10 | 0��1 | 5 | 0��1 | 5 |
| D | 40 | 5 | 0��1 | 10 | 0��1 | 5 |
��1��д��������Ӧ�����ӷ���ʽ
��2�������������յ�֪ʶ�жϣ�������ʵ���з�Ӧ�������Ŀ����� ����ʵ����ţ�
��3�������ñȽ�ijһ���ض�ʵ�������Ӱ��ʱ�������ų��������صı䶯���ţ�����Ҫ���ƺ���ʵ���� �صĸ��Ӧ���������У�
����˵���¶ȶԸ÷�Ӧ����Ӱ�����ϱȽ��� ������ʵ����ţ�
��A��B��A��C����ϱȽ����о���������
��B��C����ϱȽ����о���������
��4���̲��������˳��ֻ�ɫ�����Ŀ������ȽϷ�Ӧ���ʵĿ������������Ϊ�β�������ˮ��������λʱ������������Ĵ�С�Ŀ���ԭ��
I���跴Ӧ��Fe(s)+CO2(g)  FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��A����С��Ӧ�����ݻ�
B������Ӧ�����ݻ�
C�������¶�
D�������¶�
E��ʹ�ú��ʵĴ���
F���跨����CO����
(2)����ӦFe(s)+CO2(g)
 FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)
FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)A��ǰ�ߴ� B�����ߴ� C��һ���� D�����ж�
II��(1)ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���100��ʱ1 mol��L��1��NaOH��Һ�У���ˮ�������c(H��)��________mol��L��1��KW(25��)________KW(100��)(�>������<������)��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4HCO3���壬��ˮ�ĵ���ƽ���Ӱ����________(��ٽ����������ơ���Ӱ�족)��

(2)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݡ�
| ��ѧʽ | ����ƽ�ⳣ��(25��) |
| HCN | K��4.9��10��10 |
| CH3COOH | K��1.8��10��5 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ____��
��25 ��ʱ����ͬŨ�ȡ���ͬ�����CH3COOH��Һ��NaOH��Һ��ϣ� ������Һ��c(Na��)________c(CH3COO��)(�>������<������)
����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_______________________________��

 s���ƽ�⡣��ͼ��
s���ƽ�⡣��ͼ��