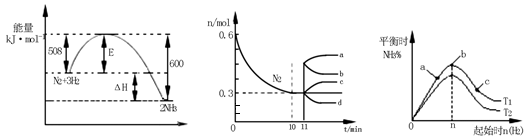
题目内容
化学反应原理在科研和生产中有广泛应用。
Ⅰ、如图装置所示,A、B中的电极为多孔的惰性电极;C、D为夹在浸有Na2SO4溶液的滤纸条上的铂夹;电源有a、b两极。若A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电。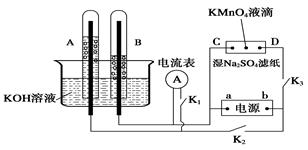
回答下列问题:
(1) a是电源的 极,写出A中的电极反应式为_____。
(2)湿的Na2SO4滤纸条上能观察到的现象有____________。
(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,发现电流表的指针移动,写出此时B中的电极反应式为 。
Ⅱ、甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
CH3OH(g) ΔH,下表所列数据是该反应在不同温度下的化学平衡常数(K)。请回答下列问题:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(4)由表中数据判断ΔH 0(填“>”、“<”或“=”)。
(5)其他条件不变,只改变其中一个条件,下列措施可提高甲醇产率的是 。
A.升高温度;B.使用合适的催化剂;C.缩小容器的容积;D.充入过量的H2;E.恒压时,充入He;F.从体系中分离出CH3OH
(6)某温度下,将2mol CO和6 mol H2充入2L密闭容器中,反应进行到4min末达到平衡,此时测得c(CO) =0.2 mol/L ,则0~4min内H2的反应速率为 ;若保持温度容积不变再向其中充入一定量的CH3OH,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气体中CH3OH的体积分数 (填“变大”、“变小”、或“不变”)。
(1)负(2分),4OH――4e―=O2↑+2H2O(2分)
(2)紫色向D极移动,C、D两极附近均有气泡产生(2分)
(3)H2―2e―+2OH―=2H2O(2分)
(4)<(2分)
(5)C、D、F(2分,少选1个扣1分,扣完为止;选错1个记0分)
(6)0.4mol/(L·min)(2分,无单位扣1分),变大(2分)
解析试题分析:(1)切断K1,闭合K2、K3通直流电,电解水槽中KOH溶液,产生氧气和氢气,所以B产生氢气,为阴极;A产生氧气,为阳极;a是电源的负极,写出A中的电极反应式为4OH――4e―=O2↑+2H2O;(2)在湿的Na2SO4滤纸条上电解水,D与电源的正极相连为阳极,阴离子高锰酸钾根离子向D极移动,两极分别产生氧气和氢气;(3)电解一段时间后,A、B中均有气体包围电极,若此时切断K2、K3,闭合K1,形成氢氧燃料电池,介质为碱性,故B中的电极反应式H2―2e―+2OH―=2H2O;
(4)该反应中温度高K值小,即温度升高平衡逆向移动,反应放热;(5)A.升高温度,平衡逆向移动,错误;B.使用合适的催化剂,平衡不移动,错误;C.缩小容器的容积增大压强,平衡正向移动,正确;D.充入过量的H2 E.恒压时,充入He,反应气体压强降低,平衡逆向移动,错误;F.从体系中分离出CH3OH,平衡正向移动,正确。
(6)0.4mol/(L·min),若保持温度容积不变再向其中充入一定量的CH3OH,导致容器中压强变大,平衡正向移动,CH3OH的体积分数变大。
考点:考查化学反应原理中电化学、热化学及化学平衡等有关问题。

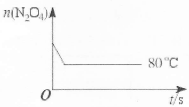
在80℃时,将0.40mo1的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| t/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K= (请注明单位)。
(3)反应进行至100s后将反应混合物的温度升高,混合气体的颜色 (填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有 (填序号)。
A.增大N2O4的起始浓度
C.使用高效催化剂
B.向混合气体中通入NO2
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在60℃时N2O4物质的量的变化曲线。
制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) 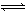 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
| 物质的量mol | 0min | 2 min | 3 min | 4 min |
| NH3 | 2.0 | 1.4 | n1 | n1 |
| CO2 | 1.0 | 0.7 | n2 | n2 |
| H2O | 0 | 0.3 | n3[ | n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为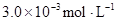 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 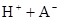 | 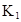 | 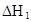 | 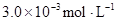 |
在苯中,2HA 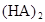 | 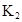 | 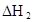 | 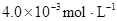 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则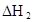 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
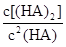 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为放热反应,理由是 。
② 理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g)
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 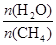 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: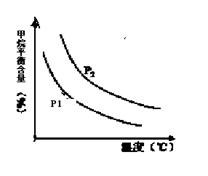
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g)
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变” 下同),H2O的体积分数
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。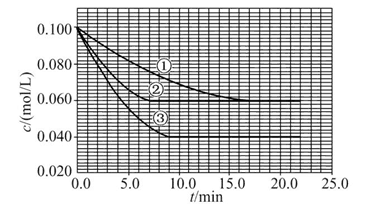
 N2O4已经达到平衡。
N2O4已经达到平衡。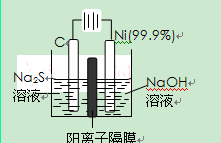
 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图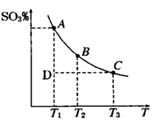 所示,根据图回答下列问题:
所示,根据图回答下列问题: