题目内容
铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
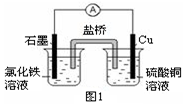
(2)图1装置发生反应的离子方程式为 。
(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
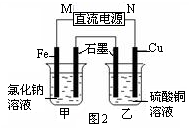
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g)
 Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |

(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。

① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
(1)①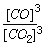 (2分) ②A (2分)
(2分) ②A (2分)
(2)2Fe3++Cu =2Fe2++Cu2+(2分)
(3)①正(2分), Fe - 2e-=Fe2+(2分)
②2CuSO4+2H2O 2Cu +O2↑ +2H2SO4 (3分) ③224(3分)
2Cu +O2↑ +2H2SO4 (3分) ③224(3分)
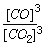 (2分) ②A (2分)
(2分) ②A (2分) (2)2Fe3++Cu =2Fe2++Cu2+(2分)
(3)①正(2分), Fe - 2e-=Fe2+(2分)
②2CuSO4+2H2O
 2Cu +O2↑ +2H2SO4 (3分) ③224(3分)
2Cu +O2↑ +2H2SO4 (3分) ③224(3分)试题分析:(1)①Fe与Fe2O3为固体,不列入平衡常数表达式。
②升高温度,平衡向右移动,c(CO)/c(CO2) 增大,A项正确;,因为反应前后气体系数相等,增大压强、充入一定量CO, c(CO)/c(CO2)不变,故B项、C项不正确;再加铁粉,平衡不移动,D项不正确。
(3)①石墨电极附近变红,H2O电离出的H+放电,使OH?浓度增大,该电极为阴极,所以N极为负极,M极为正极;甲烧杯中铁电极为阳极,Fe失电子:Fe - 2e-=Fe2+。
②电解CuSO4溶液生成Cu、O2、H2SO4,方程式为:2CuSO4+2H2O
 2Cu +O2↑ +2H2SO4。
2Cu +O2↑ +2H2SO4。③Cu电极:Cu2++2e?=Cu,n(e?)=2n(Cu2+)=2×0.64g÷64g/mol=0.02mol,串联电路中通过的电量相等,甲烧杯中石墨电极产生H2:2H++2e?=H2↑V(H2)=1/2n(e?)×22.4L/mol=0.224L=224ml。

练习册系列答案
相关题目
 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( ) 2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是
2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是 C(g),平衡时C 的体积分数为40℅。
C(g),平衡时C 的体积分数为40℅。 M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是 2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是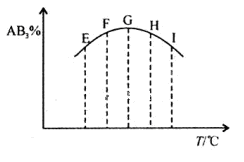
 xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是