题目内容
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)  B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是

A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡的过程中,放出的热量是154.4kJ
D.如使反应最终c(B)/c(A)=3,只能降低反应温度
 B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是
A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡的过程中,放出的热量是154.4kJ
D.如使反应最终c(B)/c(A)=3,只能降低反应温度
C
试题分析:根据c(B)="1.6" mol·L-1,n(B)=3.2mol,看图可推知n(A)=1.6mol,有三步法计算可知
2A(g)
 B(g)+C(g)
B(g)+C(g)开始 x 0 0
变化 x-1.6 3.2 3.2
平衡 1.6 3.2 3.2
可以计算出x=8mol,B错误;K=
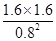 =4,A错误;如使反应最终c(B)/c(A)=3,平衡向右移动,可以降低温度或者把C分离出去,D错误;到达平衡生成B3.2mol,放出的热量是3.2×48.25=154.4kJ,正确。
=4,A错误;如使反应最终c(B)/c(A)=3,平衡向右移动,可以降低温度或者把C分离出去,D错误;到达平衡生成B3.2mol,放出的热量是3.2×48.25=154.4kJ,正确。
练习册系列答案
相关题目
 2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是
2Z(g)这是可逆反应,已知X2,Y2,Z的起始浓度分别为0.1摩尔/升,0.3摩尔/升,0.2摩尔/升,在一定条件下当反应达到平衡时,各物质浓度有可能是 2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
2AB3(g),分别在某一同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是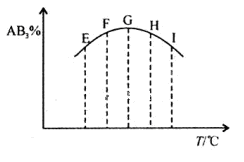
 xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
 H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是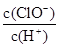 增大
增大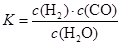
 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是