题目内容
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用下图装置模拟该法:
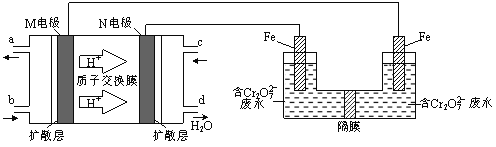
① N电极的电极反应式为 。
② 请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O7 2+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 molL﹣1 时,Cr3+沉淀完全,此时溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×1031,lg2=0.3)
【答案】
(1)①I(1分)②放③80%250℃
(2)(ΔH1-ΔH2+4ΔH3)/2
(3)①O2+4e+4H+=2H2O②1Cr2O27+6Fe2++14[H+]═2Cr3++6Fe3++7[H2O]
(4)5.6
【解析】
试题分析:(1)①反应I中所用原材料原子均转化到最终产物中,原子利用率为100%最经济,反应Ⅰ符合“原子经济”;
②根据表格提供的信息,温度升高,K值减小,说明平衡向逆反应方向移动,所以反应I为放热反应。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,物质的量为0.4mol,则CO的转化率为(2-0.4)mol÷2mol×100%=80%,K=0.8÷(0.2×1.4×1.4)=2.041,此时的温度为250℃。
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1 kJ/mol,
②2CO(g)+O2(g)=2CO2(g)ΔH2 kJ/mol,
③H2O(g)=H2O(l)ΔH3 kJ/mol,根据盖斯定律,(①﹣②+4×③)÷3可得
CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=(ΔH1-ΔH2+4ΔH3)/2kJ/mol。
(3)①氢离子通过质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为CH3OH﹣6e-+ H2O = 6H++ CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为O2+4e+4H+=2H2O。
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72﹣还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72﹣的系数为1,Fe2+的系数为6,反应离子方程式为Cr2O27 +6 Fe2++14H+═ 2 Cr3++6 Fe3++7H2O。
(4)Ksp=c(Cr3+)×c3(OH﹣)=6.4×1031,c(Cr3+)=1×105molL﹣1 时,溶液中c(OH﹣)=4×109molL﹣1,则c(H+)=10-14÷(4×10-9)mol/L=2.5×106molL﹣1,则pH=﹣lg2.5×106=5.6。

 阅读快车系列答案
阅读快车系列答案