题目内容
【题目】某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
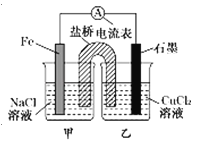
A.原电池的总反应为Fe+Cu2+═Fe2++Cu
B.盐桥中是KNO3溶液,则盐桥中NO3﹣移向乙烧杯
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e﹣═H2↑
D.反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子
【答案】B
【解析】
试题分析:A.根据图示可知,在该原电池中,负极是Fe,发生反应:Fe-2e-=Fe2+,石墨为正极,在正极上发生反应:Cu2++2e-=Cu,所以总反应方程式是Fe+Cu2+ =Fe2++Cu,A正确;B.盐桥中是KNO3 溶液,则根据同种电荷相互排斥,异种电荷相互吸引的原则,盐桥中NO3-移向正电荷较多的甲烧杯,B错误;C. 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,由于溶液中阳离子获得电子的能力H+>NH4+,在正极石墨电极反应式为2H++2e-=H2↑,C正确;D.反应前,电极质量相等,由于阳极发生反应:Fe-2e-=Fe2+,每转移2mol电子,负极减少质量56g,在正极发生反应:Cu2++2e-=Cu,质量增加64g,两个电极质量相差120g,则电解一段时间后,两电极质量相差12 g,(12÷120)×2mol=0.2 mol,D正确,答案选B。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
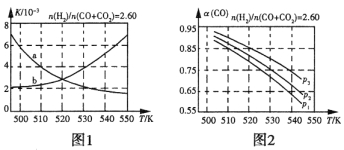
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______________热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用下图装置模拟该法:
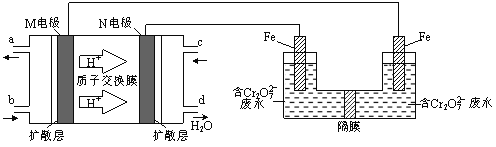
① N电极的电极反应式为 。
② 请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O7 2+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 molL﹣1 时,Cr3+沉淀完全,此时溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×1031,lg2=0.3)