ĢāÄæÄŚČŻ
”¾ĢāÄæ”æÅšÄąÖ÷ŅŖÓÉMgOŗĶSiO2×é³É£¬ŗ¬ÓŠÉŁĮæFe2O3”¢FeO”¢Al2O3µČŌÓÖŹ”£ÓĆÅšÄąÉś²śĒāŃõ»ÆĆ¾µÄ¹¤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾£ŗ
ŅŃÖŖijŠ©ĒāŃõ»ÆĪļ³ĮµķµÄpHČēĻĀ±ķĖłŹ¾£ŗ
ĒāŃõ»ÆĪļ | æŖŹ¼³ĮµķŹ±µÄpH | ĶźČ«³ĮµķŹ±µÄpH |
Mg£ØOH£©2 | 9.3 | 10.8 |
Fe£ØOH£©2 | 7.6 | 9.6 |
Al£ØOH£©3 | 4.1 | 5.4 |
Fe£ØOH£©3 | 2.7 | 3.7 |
£Ø1£©MgOµÄµē×ÓŹ½ĪŖ £¬¼ÓČėH2O2µÄÄæµÄŹĒ______________”£
£Ø2£©ĀĖŌü2µÄÖ÷ŅŖ³É·ÖŹĒ £¬ĻņĀĖŌü2ÖŠ¼ĢŠų¼ÓČė¹żĮæµÄNaOHČÜŅŗ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø3£©¼ÓČėNaOHµ÷½ŚČÜŅŗpH=12.0Ź±£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©ĄūÓĆMg£ØOH£©2Óėŗ¬SO2µÄŃĢĘų·“Ӧɜ³ÉMgSO4£¬æÉŅŌŹ¹ŃĢĘųĶŃĮņ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø5£©ČōČ”a¶ÖÅšÄąĪŖŌĮĻ£¬×īŗóµĆµ½b¶ÖMg£ØOH£©2²śĘ·£Ø¼ŁÉčÉś²ś¹ż³ĢÖŠĆ¾ŌŖĖŲĪŽĖšŹ§£©£¬ŌņÅšÄąÖŠMgOµÄÖŹĮæ·ÖŹżĪŖ £ØÓĆŗ¬ÓŠa”¢bµÄ“śŹżŹ½±ķŹ¾£©”£
”¾“š°ø”æ
£Ø1£©![]() ½«Fe2£«Ńõ»ÆĪŖFe3£«
½«Fe2£«Ńõ»ÆĪŖFe3£«
£Ø2£©Fe(OH)3”¢Al(OH)3 Al(OH)3+OH£=[Al(OH)4]-
£Ø3£©Mg2£«+2OH£=Mg(OH)2”ż
£Ø4£©2Mg(OH)2+2SO2 +O2 =2MgSO4+2H2O
£Ø5£©![]() ”Į100%
”Į100%
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©MgOŹĒĄė×Ó»ÆŗĻĪļ£¬µē×ÓŹ½ĪŖ![]() £»Fe2£«¾ßÓŠ»¹ŌŠŌ£¬H2O2¾ßÓŠŃõ»ÆŠŌ£¬ĖłŅŌ¼ÓČėH2O2µÄÄæµÄŹĒ½«Fe2£«Ńõ»ÆĪŖFe3£«”£
£»Fe2£«¾ßÓŠ»¹ŌŠŌ£¬H2O2¾ßÓŠŃõ»ÆŠŌ£¬ĖłŅŌ¼ÓČėH2O2µÄÄæµÄŹĒ½«Fe2£«Ńõ»ÆĪŖFe3£«”£
£Ø2£©MgO”¢Fe2O3”¢FeO”¢A12O3¾łæÉČÜÓŚĮņĖį£¬ĀĖŌü1ŹĒSiO2£¬¼ÓČėĖ«ŃõĖ®Ńõ»Æ£¬ŌŁµ÷½ŚČÜŅŗpH=6Ź±£¬ÓÉĢāøųŠÅĻ¢£¬ĀĖŌü2ŹĒFe(OH)3”¢Al(OH)3£»µ±¼ÓČėNaOHŹ±£¬Al(OH)3Čܽā£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖAl(OH)3+OH£=[Al(OH)4]-”£
£Ø3£©µ÷½ŚČÜŅŗpH=12£®0Ź±£¬Mg±»³Įµķ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖMg2£«+2OH£=Mg(OH)2”ż£»
£Ø4£©øĆ·“Ó¦Ņ»¶ØÓŠŃõĘų²Ī¼Ó£¬»Æѧ·½³ĢŹ½ŹĒ2Mg(OH)2+2SO2 +O2 =2MgSO4+2H2O£»
£Ø5£©ÉčMgOµÄÖŹĮæ·ÖŹżĪŖx£¬ŌņÓÉMgŹŲŗć£¬b/56=ax/40£¬½āµĆ£ŗx=![]() ”Į100%”£
”Į100%”£

”¾ĢāÄæ”æ¼×“¼¼ČæÉÓĆÓŚ»ł±¾ÓŠ»śŌĮĻ£¬ÓÖæÉ×÷ĪŖČ¼ĮĻÓĆÓŚĢę“śæóĪļČ¼ĮĻ”£
£Ø1£©ŅŌĻĀŹĒ¹¤ŅµÉĻŗĻ³É¼×“¼µÄĮ½øö·“Ó¦£ŗ
·“Ó¦I£ŗ CO£Øg£©£«2H2£Øg£©![]() CH3OH£Øg£© ¦¤H1
CH3OH£Øg£© ¦¤H1
·“Ó¦II£ŗCO2£Øg£©£«3H2£Øg£©![]() CH3OH£Øg£©+ H2O£Øg£© ¦¤H2
CH3OH£Øg£©+ H2O£Øg£© ¦¤H2
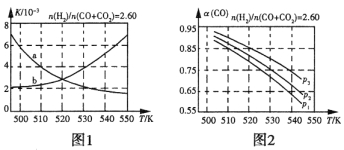
¢Ł ÉĻŹö·“Ó¦·ūŗĻ”°Ō×Ó¾¼Ć”±ŌŌņµÄŹĒ £ØĢī”°I”±»ņ”°II”±£©”£
¢Ś ĻĀ±ķĖłĮŠŹż¾ŻŹĒ·“Ó¦IŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄ»ÆŃ§Ę½ŗā³£Źż£ØK£©”£
ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
K | 2.041 | 0.270 | 0.012 |
ÓɱķÖŠŹż¾ŻÅŠ¶Ļ·“Ó¦IĪŖ______________ČČ·“Ó¦£ØĢī”°Īü”±»ņ”°·Å”±£©”£
¢Ū ijĪĀ¶ČĻĀ£¬½«2 mol COŗĶ6 mol H2³äČė2LµÄĆܱÕČŻĘ÷ÖŠ£¬³ä·Ö·“Ó¦£¬“ļµ½Ę½ŗāŗ󣬲āµĆc(CO)£½ 0£®2 mol/L£¬ŌņCOµÄ×Ŗ»ÆĀŹĪŖ £¬“ĖŹ±µÄĪĀ¶ČĪŖ £Ø“Ó±ķÖŠŃ”Ōń£©”£
£Ø2£© ŅŃÖŖŌŚ³£ĪĀ³£Ń¹ĻĀ£ŗ
¢Ł2CH3OH£Øl£©£«3O2£Øg£©£½2CO2£Øg£©£«4H2O£Øg£© ¦¤H1 kJ/mol
¢Ś2CO£Øg£©+O2£Øg£©£½2CO2£Øg£© ¦¤H2 kJ/mol
¢ŪH2O£Øg£©£½H2O£Øl£© ¦¤H3 kJ/mol
Ōņ·“Ó¦ CH3OH£Øl£©+ O2£Øg£©£½ CO£Øg£©+ 2H2O£Øl£© ¦¤H£½ kJ/mol
£Ø3£©ĻÖŅŌ¼×“¼Č¼ĮĻµē³Ų£¬²ÉÓƵē½ā·ØĄ““¦ĄķĖįŠŌŗ¬øõ·ĻĖ®(Ö÷ŅŖŗ¬ÓŠCr2O72)Ź±£¬ŹµŃéŹŅĄūÓĆĻĀĶ¼×°ÖĆÄ£ÄāøĆ·Ø£ŗ
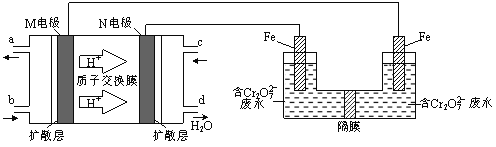
¢Ł Nµē¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
¢Ś ĒėĶź³Éµē½ā³ŲÖŠCr2O72×Ŗ»ÆĪŖCr3+µÄĄė×Ó·“Ó¦·½³ĢŹ½£ŗ
Cr2O7 2+ Fe2+ + [ ] ØT Cr3++ Fe3++ [ ]
£Ø4£© “¦Ąķ·ĻĖ®Ź±£¬×īŗóCr3+ŅŌCr(OH)3ŠĪŹ½³żČ„£¬µ±c(Cr3+)=1”Į105 molL©1 Ź±£¬Cr3+³ĮµķĶźČ«£¬“ĖŹ±ČÜŅŗµÄpH= ”£ (ŅŃÖŖ£¬ Ksp[Cr(OH)3]=6.4”Į1031£¬lg2=0.3)