题目内容
14.短周期元素Q、W、X、Y、Z原子序数依次增大,X元素的焰色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍.W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元索.下列说法正确的是( )| A. | 原子半径的大小顺序:rX>rY>rW>rQ | |
| B. | 工业上常用电解的方法制备X,Y的单质 | |
| C. | 元素Q和Z能形成QZ2的共价化合物为原子晶体 | |
| D. | 元素X、Y的最高价氧化物对应水化物之间不能反应 |
分析 Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,最外层电子数为4,故Q为碳元素;W、Z最外层电子数相同,二者处于同一主族,Z的核电荷数是W的2倍,故Z为硫元素,W为氧元素;Y是地壳中含量最多的金属元索,则Y为Al元素,据此解答.
解答 解:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,则X为Na元素;Q元素的原子最外层电子数是其内层电子数的2倍,Q元素原子有2个电子层,最外层电子数为4,故Q为碳元素;W、Z最外层电子数相同,二者处于同一主族,Z的核电荷数是W的2倍,故Z为硫元素,W为氧元素;Y是地壳中含量最多的金属元索,则Y为Al元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>C>O,即rx>ry>rQ>rW,故A错误;
B.工业上用电解熔融氯化钠冶炼钠,电解熔融氧化铝冶炼铝,故B正确;
C.CS2属于共价化合物,故C错误;
D.元素X、Y的最高价氧化物对应水化物分别为NaOH、氢氧化铝,氢氧化铝是两性氢氧化物,与氢氧化钠反应生成偏铝酸钠、水,故D错误;
故选B.
点评 本题考查结构性质位置关系,难度不大,推断元素是解题的关键,注意掌握半径比较规律.

练习册系列答案
相关题目
4.下列物质的电子式书写正确的是( )
| A. | 氯化氢  | B. | 二氧化碳  | ||
| C. | 氮气  | D. | 氯化镁  |
5.下列物质中互为同分异构体的是( )
| A. | 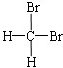 与 与 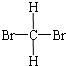 | B. | 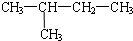 与 与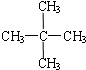 | C. | CH4和CH3CH3 | D. | 淀粉和纤维素 |
9.下列推论正确的是( )
| A. | SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子 | |
| D. | NH4+为正四面体结构,可推测 PH4+ 也为正四面体结构 |
19.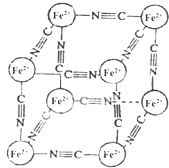 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特征:Fe2+位于立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,M为+1价.晶体的晶胞结构如图所示,下列说法不正确的是( )| A. | 该晶体中既有离子键又有极性共价键 | |
| B. | 晶体的化学式可表示为[M2Fe(CN)3] | |
| C. | M+离子位于晶胞体心 | |
| D. | 与每个Fe2+距离相等且最近的CN-有6个 |
6.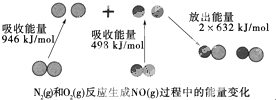 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
3.下列排列顺序正确的是( )
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油.
①固体热稳定性:Na2CO3>CaCO3>NaHCO3
②微粒半径:F->Na+>Mg2+>S2-
③燃烧热:S(气体)>S(液体)>S(固体)
④物质的熔点:植物油>动物油.
| A. | ①③④ | B. | ①③ | C. | ①②③④ | D. | ②③④ |
4.下列B组中命题正确且能用A组命题加以正确解释的是( )
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 Ⅱ.H-I键键能小于H-Cl键键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HI比HCl不稳定 ③HI沸点比HCl高 ④HI沸点比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
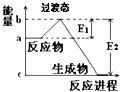 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是放热(填“吸热”或“放热”)反应,NO2和CO的总能量>(填“>”、“<”或“=”)CO2和NO的总能量.