题目内容
9.将7.8gNa2O2:加入100g水中,充分反应后得到密度为1.02g/cm3的溶液.(1)溶液的质量分数为0.075(保留3位小数).
(2)溶液的物质的量浓度为1.91mol/L(保留2位小数).
分析 n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,与水发生2Na2O2+2H2O=4NaOH+O2↑,根据反应的化学方程式可计算生成溶质的质量和溶液的质量,以此可计算溶液的质量分数,物质的量浓度计算公式计算浓度.
解答 解:(1)n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,与水发生2Na2O2+2H2O=4NaOH+O2↑,
由方程式可知n(NaOH)=0.2mol,n(O2)=0.05mol,
则m(NaOH)=0.2mol×40g/mol=8g,m(O2)=0.05mol×32g/mol=1.6g,
则所得溶液的质量分数为$\frac{8.0g}{7.8g+100g-1.6g}$×100%=0.075,故答案为:0.075;
(2)c=$\frac{1000ρA%}{M}$=$\frac{1000×1.02×0.075}{40}$=1.91,故答案为:1.91.
点评 本题以钠的化合物为载体考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握反应的方程式的书写,为解答该题的关键,难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
19.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示,下列说法正确的是( )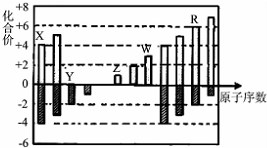

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y、R都存在同素异形现象 | |
| C. | Z和Y形成的化合物只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断正确的是( )
| A. | 原子半径由小到大的顺序:r(C)<r(D)<r(E) | |
| B. | 元素D、E分别与A形成的化合物的热稳定性:E>D | |
| C. | 元素D的最高价氧化物对应水化物的酸性比E的强 | |
| D. | 元素B分别与A、C形成的化合物中化学键的类型不同 |
4.密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s)?2CaO(s)+O2(g)并达到平衡.保持温度不变,缩小容器容积为原来的三分之二,重新平衡后,下列叙述正确的是( )
| A. | 平衡常数减小 | B. | CaO的量减少 | C. | 氧气浓度不变 | D. | CaO2的量不变 |
14.结构片段为…-CH2-CH=CH-CH2-…的高分子化合物的单体是( )
| A. | 乙烯 | B. | 乙炔 | C. | 正丁烯 | D. | 1,3-丁二烯 |
1.分子式为CnH2nO2的羧酸和某醇发生酯化反应生成分子式为Cn+6H2n+12O2的酯,反应所需羧酸和醇的质量比为1:1,则该羧酸的同分异构体中属于酯的有( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
10.下列变化属于化学变化的是( )
| A. | 碘的升华 | B. | 用CCl4萃取溴水中的溴 | ||
| C. | AgBr感光 | D. | 浓盐酸的挥发 |
 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )