题目内容
11.下列反应的离子方程式书写正确的是( )| A. | 钠和水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
分析 A.离子方程式两边正电荷不相等,违反的电荷守恒;
B.等物质的量的氢氧化钡与硫酸氢铵反应,铵根离子、氢离子恰好与氢氧根离子反应,漏掉了铵根离子与氢氧根离子的反应;
C.酸性溶液中,反应产物不会生成氢氧根离子;
D.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢根离子.
解答 解:A.钠和水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.等物质的量的NH4HSO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀、一水合氨和水,正确的离子反应为:NH4++H++SO42-+Ba2++2OH-═NH3•H2O+H2O+BaSO4↓,故B错误;
C.用过氧化氢从酸化的海带灰浸出液中提取碘,反应生成碘单质和水,正确的离子反应为:2I-+H2O2+2H+═I2+2H2O,故C错误;
D.NaAlO2溶液中通入过量CO2制Al(OH)3,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 单质硅化学性质稳定,但自然界不存在游离态的硅 | |
| B. | 氨气的水溶液能导电,说明氨气是电解质 | |
| C. | SO2使溴水或品红溶液褪色,体现了SO2的漂白性 | |
| D. | 镁、铝、铜等金属一般采用热还原法冶炼 |
19.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示,下列说法正确的是( )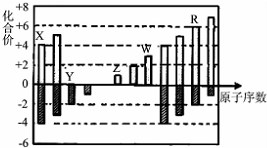

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y、R都存在同素异形现象 | |
| C. | Z和Y形成的化合物只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
6.下列有关说法中,正确的是( )
| A. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| B. | 用福尔马林(甲醛溶液)浸泡海产品,可长时间保鲜 | |
| C. | 粮食酿酒主要经过淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 明矾既可用于净水,也可杀菌消毒 |
16.某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+.将溶液滴在蓝色石蕊试纸上,试纸变红.取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀.下列判断合理的是( )
| A. | 可能有Cl-和SO42- | B. | 一定有Al3+ 和SO42- | ||
| C. | 可能有Al3+ 和Cl- | D. | 一定没有CO32- |
3.某药物中间体的合成路线如下:下列说法正确的是( )
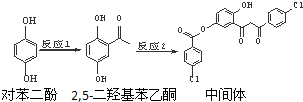

| A. | 对苯二酚和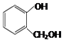 互为同系物 互为同系物 | |
| B. | 1 mol该中间体最多可与7 mol氢氧化钠反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解等反应 | |
| D. | 该中间体分子含有羰基和羟基两种含氧官能团 |
20.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断正确的是( )
| A. | 原子半径由小到大的顺序:r(C)<r(D)<r(E) | |
| B. | 元素D、E分别与A形成的化合物的热稳定性:E>D | |
| C. | 元素D的最高价氧化物对应水化物的酸性比E的强 | |
| D. | 元素B分别与A、C形成的化合物中化学键的类型不同 |