题目内容
14.酸、碱、盐在水溶液中均能电离成离子,写出其电离方程式(1)H2SO4=H2SO4=2H++SO42-
(2)Ba(OH)2=Ba(OH)2=Ba2++2OH-
(3)NaClO=NaClO=Na++ClO-.
分析 (1)硫酸为强电解质,完全电离产生氢离子与硫酸根离子,用等号;
(2)氢氧化钡为强电解质,完全电离产生钡离子和氢氧根离子,用等号;
(3)次氯酸钠为强电解质,完全电离产生钠离子和次氯酸根离子,用等号.
解答 解:(1)硫酸为强电解质,完全电离产生氢离子与硫酸根离子,电离方程式:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)氢氧化钡为强电解质,完全电离产生钡离子和氢氧根离子,电离方程式:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
(3)次氯酸钠为强电解质,完全电离产生钠离子和次氯酸根离子,电离方程式:NaClO=Na++ClO-;
故答案为:NaClO=Na++ClO-;
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方程式书写方法即可解答,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
4.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
5.下列反应中,属于吸热反应的是( )
| A. | 甲烷在氧气中燃烧 | |
| B. | 稀硫酸和氢氧化钠溶液发生中和反应 | |
| C. | 金属钠和水反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | C. | B的物质的量浓度 | D. | 物质A的质量 |
9.下列说法中正确的是( )
| A. | 1mol任何气体的体积都约为22.4L | |
| B. | 0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| C. | 在标准状况下,2mol酒精的体积约为44.8L | |
| D. | 常温常压下,质量为32g的O2含有的分子数为NA |
19.下列说法正确的是( )
| A. | 1molH2的体积为22.4L | |
| B. | Na+的摩尔质量是23 g/mol | |
| C. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| D. | 标准状况下,将22.4LHCl溶于1L水中,其物质的量浓度为1mol/L |
6.下列与实验相关的叙述正确的是( )
| A. | Hg(NO3)2溶于水,可将含有Hg(NO3)2的废液倒入水池中,再用水冲入下水道 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,必须冷却至室温才能转移到容量瓶中 | |
| D. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
3.下列说法不正确的是( )
| A. | 0.3mol/L的MgCl2溶液和0.2mol/L的AlCl3中Cl-的物质的量浓度不相同 | |
| B. | 氧化还原反应过程中一定存在电子的得失或共用电子对的偏移 | |
| C. | 无论什么状况下,质量一定的某种气体含有的分子数是一定的 | |
| D. | 相同状况下,气体的相对分子质量越大则气体密度越大 |
4.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)?2C(g)△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出关系图:
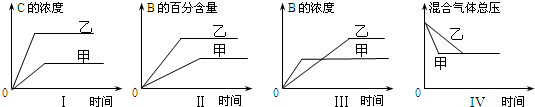
下列判断正确的是( )

下列判断正确的是( )
| A. | 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且乙的压强较高 | |
| C. | 图Ⅲ研究的是温度对反应的影响,且甲的温度较高 | |
| D. | 图IV 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |