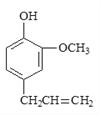
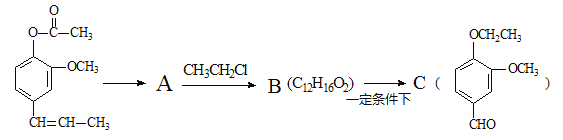题目内容
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
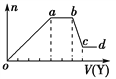
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________, bc段发生反应的离子方程式是________________________,
(2)若Y是NaOH溶液,则X中一定含有的离子是______________________,bc段发生反应的离子方程式是_____________________________________。
【答案】 SiO32-、AlO2- Al(OH)3+3 H+ =Al3++3 H2O Al3+、Mg2+、NH4+、Cl- Al(OH)3+OH-= AlO2-+2 H2O
【解析】试题分析:(1)CO![]() 、SiO
、SiO![]() 、AlO
、AlO![]() 结合质子的能力是SiO
结合质子的能力是SiO![]() >AlO
>AlO![]() > CO
> CO![]() ,SiO
,SiO![]() 与氢离子反应生成硅酸沉淀、AlO
与氢离子反应生成硅酸沉淀、AlO![]() 与氢离子反应生成氢氧化铝沉淀;CO
与氢离子反应生成氢氧化铝沉淀;CO![]() 与氢离子反应生成二氧化碳气体;氢氧化铝能溶于过量的稀盐酸;Al3+、Fe3+、Mg2+都能与氢氧化钠反应生成沉淀,NH
与氢离子反应生成二氧化碳气体;氢氧化铝能溶于过量的稀盐酸;Al3+、Fe3+、Mg2+都能与氢氧化钠反应生成沉淀,NH![]() 与NH4+与OH-反应生成一水合氨;氢氧化铝能溶于过量的氢氧化钠。
与NH4+与OH-反应生成一水合氨;氢氧化铝能溶于过量的氢氧化钠。
解析:根据以上分析,(1)若Y是盐酸, oa段生成沉淀,转化为沉淀的离子是SiO32-、AlO2-, bc段沉淀质量减小,为氢氧化铝能溶于过量的稀盐酸,发生反应的离子方程式是Al(OH)3+3 H+ =Al3++3 H2O。
(2)某无色稀溶液X,一定不含Fe3+;若Y是NaOH溶液,oa段生成沉淀,X中含有Al3+、Mg2+中的至少一种,ab沉淀质量不变,则X中一定含有NH![]() ;bc段沉淀减少,水氢氧化铝溶于过量的氢氧化钠,X溶液中一定含有Al3+,最终沉淀质量不为0,X溶液中一定含有Mg2+;Al3+与CO
;bc段沉淀减少,水氢氧化铝溶于过量的氢氧化钠,X溶液中一定含有Al3+,最终沉淀质量不为0,X溶液中一定含有Mg2+;Al3+与CO![]() 、SiO
、SiO![]() 、AlO
、AlO![]() 不能共存,根据电荷守恒,一定有Cl-;所以一定含有的离子是Al3+、Mg2+、NH4+、Cl-,bc段发生反应的离子方程式是Al(OH)3+OH-= AlO2-+2 H2O。
不能共存,根据电荷守恒,一定有Cl-;所以一定含有的离子是Al3+、Mg2+、NH4+、Cl-,bc段发生反应的离子方程式是Al(OH)3+OH-= AlO2-+2 H2O。