题目内容
【题目】现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有(填代号),还缺少的仪器是 .
(2)经计算,需量取浓H2SO4的体积为mL.
(3)配制步骤:量取浓硫酸,小心地倒入盛有少量蒸馏水的烧杯中,搅拌均匀,待冷却至室温后转移到100mL容量瓶中,用少量的蒸馏水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入蒸馏水至刻度线,定容,塞好瓶塞,反复上下颠倒摇匀.
①定容的正确操作是继续加蒸馏水至离刻度线下时,改用胶头滴管加水至凹液面最低处与刻度线相切.
②用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是(填序号).
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(4)配制时下列操作会导致所配溶液浓度偏高的是 .
a.转移时有少量溶液溅出 b.定容时俯视刻度线
c.容量瓶用蒸馏水洗净后未干燥 d.用量筒量取浓硫酸时,俯视刻度线
e.稀释后未经冷却就转移定容
(5)图是该同学转移溶液的示意图,其中的错误是 ![]()
【答案】
(1)②⑥;100ml容量瓶
(2)19.6
(3)1﹣2cm;重新配制
(4)be
(5)没有用玻璃棒引流
【解析】解:(1)配制一定物质的量浓度硫酸溶液的一般步骤有:量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、500ml容量瓶,所以用不到的仪器有烧瓶、托盘天平,还缺少的仪器为:100ml容量瓶;所以答案是:②⑥;100ml容量瓶;(2)质量分数98%密度为1.84gcm﹣3浓H2SO4的物质的量浓度= ![]() mol/L=18.4mol/L;设需要浓硫酸溶液的体积为V,3.6molL﹣1×100mL=V×18.4mol/L,解得:V=19.6mL,
mol/L=18.4mol/L;设需要浓硫酸溶液的体积为V,3.6molL﹣1×100mL=V×18.4mol/L,解得:V=19.6mL,
所以答案是:19.6mL;(3)①定容的正确操作是继续加蒸馏水至离刻度线1﹣2cm,改用胶头滴管加水至凹液面最低处与刻度线相切;
所以答案是:1﹣2cm;②用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,实验失败,且无法补救,必须重新配制;
所以答案是:重新配制(4)a.转移时有少量溶液溅出,会导致浓度偏低;
b.定容时俯视刻度线,导致体积偏小,则浓度偏大;
c.容量瓶用蒸馏水洗净后未干燥,对实验无影响;
d.用量筒量取浓硫酸时,俯视刻度线,导致量取液体偏小,则配制浓度偏小;
e.稀释后未经冷却就转移定容,可导致液体体积偏小,浓度偏大,
所以答案是:be;(5)移液时应防止溶液流出,应用玻璃棒引流,所以答案是:没有用玻璃棒引流.
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.

【题目】下表是A、B、C三种有机物的有关信息。
A | B | C |
能使溴的四氯化碳溶液褪色;比例模型为
| 由C、H、O三种元素组成 ②球棍模型为 | ①由C、H、Br三种元素组成②相对分子质量为151 |
(1)A与氢气发生加成反应后生成分子D,在D的同系物中,当碳原子数n=________时,这类有机物开始有同分异构体。
(2)B与浓溴水反应的化学方程式为___________________________________
(3)若C分子中含有3个甲基,则有机物C的结构(不考虑立体异构)有_________种,其中核磁共振氢谱有3组峰,且峰面积之比为6:3:2的结构简式为 _______________________
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
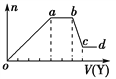
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是________, bc段发生反应的离子方程式是________________________,
(2)若Y是NaOH溶液,则X中一定含有的离子是______________________,bc段发生反应的离子方程式是_____________________________________。
【题目】已知2SO2(g)+O2(g)2SO3(g)△H=﹣197kJmol﹣1,按不同方式向甲、乙和丙3个相同容器内投入反应物,且保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 2molSO2、1molO2 | 1molSO2、0.5molO2 | 2molSO3 |
平衡常数 | K1 | K2 | K3 |
反应的能量变化 | 放出akJ | 放出bkJ | 吸收ckJ |
气体密度 | ρ1 | ρ2 | ρ3 |
反应物转化率 | α1 | α2 | α3 |
下列有关关系式正确的是( )
A. K1=K3<K2 B. ρ1=ρ3>ρ2 C. α2+α3>1 D. 2b+c>197