题目内容
【题目】某同学用含结晶水的盐X(四种短周期元素组成的纯净物)进行了如下实验:
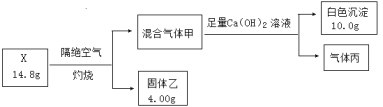
已知:i.气体甲无色无味气体;
ii.气体丙为纯净物,干燥后体积为2.24L(标况下),标况下密度为1.25g·L-1,易与血红蛋白结合而造成人中毒;
iii.固体乙为常见金属氧化物,其中氧元素的质量分数为40%。
请回答:
(1)X中除H、O两种元素外,还含有_____元素,混合气体甲的成分是_____(填化学式)。
(2)将X加入到硫酸酸化的高锰酸钾溶液,溶液褪色并有气体产生,写出该化学方程式___。
【答案】Mg、C CO、CO2、H2O 5MgC2O4·2H2O +8H2SO4 +2KMnO4=5MgSO4 + K2SO4 +2MnSO4 + 10CO2↑+18H2O
【解析】
(1)由i.气体甲无色无味气体,由流程知甲中含有二氧化碳,根据白色沉淀的质量可计算CO2物质的量;
ii.气体丙为纯净物,干燥后体积为2.24L(标况下),则其物质的量为0.1mol,按标况下密度可知其摩尔质量,按性质,则可判断出丙,用质量守恒求出混合气体还含有的水蒸气的物质的量;
iii.固体乙为常见金属氧化物,设其化学式为M2Ox,按其中氧元素的质量分数为40%,则可判断出所含金属元素,按数据可得盐的化学式;
(2)将X加入到硫酸酸化的高锰酸钾溶液,利用其性质写出和硫酸酸化的高锰酸钾溶液发生氧化还原反应化学方程式;
i.气体甲无色无味气体,由流程知甲中含有二氧化碳,根据C守恒,CO2物质的量为10.0g÷100g/mol=0.1mol;
ii.气体丙为纯净物,干燥后体积为2.24L(标况下),则其物质的量为2.24L÷22.4L/mol=0.1mol,丙标况下密度为1.25g·L-1,则丙的摩尔质量=22.4L/mol×1.25g·L-1=28 g /mol,丙易与血红蛋白结合而造成人中毒,则丙为CO;根据题意X为含结晶水的盐,则混合气体甲中还含有14.8g-4.00g-0.1 mol×28 g /mol-0.1 mol×44 g /mol=3.6g水蒸气,水蒸气物质的量为3.6g÷18g/mol=0.2mol;
iii.固体乙为常见金属氧化物,设其化学式为M2Ox,因为其中氧元素的质量分数为40%,则![]() ,则Ar(M)=12x,当x=2,Ar(M)=24时合理,即M为Mg元素,且MgO物质的量为4g÷40g/mol=0.1mol;
,则Ar(M)=12x,当x=2,Ar(M)=24时合理,即M为Mg元素,且MgO物质的量为4g÷40g/mol=0.1mol;
则镁、碳、氢、氧的物质的量分别为0.1mol、0.2mol(0.1mol+0.1mol=0.2mol)、0.4mol(0.2mol×2=0.4mol)、0.6mol(0.1mol+0.1mol+0.1mol×2+0.2mol),则X的化学式为MgC2H4O6,已知X为含结晶水的盐 (四种短周期元素组成的纯净物),镁离子和结晶水的物质的量之比为1:2,则其化学式为MgC2O4·2H2O;
(1)X中除H、O两种元素外,还含有Mg、C元素,混合气体甲的成分是CO、CO2、H2O;
答案为:Mg、C ;CO、CO2、H2O;
(2) 将X加入到硫酸酸化的高锰酸钾溶液,溶液褪色并有气体产生,则KMnO4被还原为Mn2+,C2O42-被氧化成CO2,根据得失电子守恒、原子守恒,该反应的化学方程式为:5MgC2O4·2H2O +8H2SO4 +2KMnO4=5MgSO4 + K2SO4 +2MnSO4 + 10CO2↑+18H2O;
答案为:5MgC2O4·2H2O +8H2SO4 +2KMnO4=5MgSO4 + K2SO4 +2MnSO4 + 10CO2↑+18H2O。