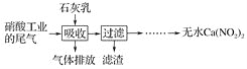
题目内容
【题目】下列说法不正确的是
A.2 mol Na2O2与足量水发生反应转移4 mole-
B.少量的金属钠保存在煤油中
C.现代化学已经成为实验与理论并重的科学
D.高炉炼铁中实际起还原作用的是一氧化碳
【答案】A
【解析】
Na2O2与足量水发生反应既做氧化剂也做还原剂,细心分析转移的电子数;金属钠很活泼,
要保存在煤油中;一氧化碳具有还原性,可做还原剂。
A.![]() ,过氧化钠既做氧化剂也做还原剂,有关系式:
,过氧化钠既做氧化剂也做还原剂,有关系式:![]() ,故2 mol Na2O2参与反应,转移的电子为2 mol,故A错误;
,故2 mol Na2O2参与反应,转移的电子为2 mol,故A错误;
B.金属钠很活泼,易与水及氧气反应,所以要保存在煤油中,隔绝氧气和水,B正确;
C.化学是一门以实验为基础的学科,理论与实验同样重要,C正确;
D.高炉炼铁是将铁的金属氧化物转化为金属铁,所以需要还原剂,一氧化碳具有还原性,在该过程中做还原剂,故D正确;
答案选A。

 新思维寒假作业系列答案
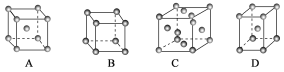
新思维寒假作业系列答案【题目】I.金属晶体中金属原子主要有三种常见的堆积方式,体心立方堆积、面心立方堆积和六方堆积。
(1)金属铜采用下列________(填字母代号)堆积方式。
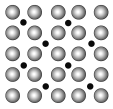
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
II.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的外围电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1)A和B的离子中,半径较小的是________(填离子符号)。
(2)A、D分别与B形成的化合物中,________的晶格能大(填化学式)。
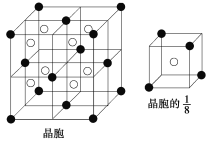
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是____________。A和E化合物的晶胞1/8的体积为2.0×10-23 cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):__________________________________________。
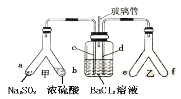
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
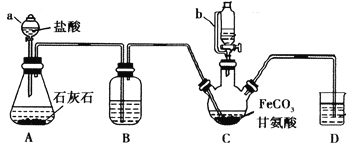
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。