题目内容
【题目】下列装置一定能证明2Ag++2I-=2Ag+I2能否自发进行的是
A.  B.
B. 
C. 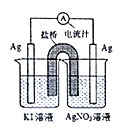 D.
D. 
【答案】C
【解析】
A、反应产生黄色沉淀,证明碘化钾与硝酸银反应生成碘化银和硝酸钾,不符合,选项A不选;B、两个电极为石墨电极不能发生自发的氧化还原反应,无法形成原电池,无法证明2Ag++2I-=2Ag+I2能否自发进行,不符合,选项B不选;C、左边银电极上碘离子失电子产生碘单质,右边银离子在电极上得电子析出银,能证明2Ag++2I-=2Ag+I2能否自发进行,符合,选项C选;D、碘化银连接电源的正极氢氧根离子失电子产生氧气,银电极连接电源负极银离子得电子产生银单质,证明电解硝酸银产生银、氧气和硝酸,无法证明2Ag++2I-=2Ag+I2能否自发进行,不符合,选项D不选。答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式______________________(中和热ΔH=-57.3 kJ/mol)。
L-1硫酸滴定,写出该中和反应的热化学方程式______________________(中和热ΔH=-57.3 kJ/mol)。
(2)将该烧碱样品配成500mL待测溶液需要的玻璃仪器有________________________。
(3)滴定过程中,眼睛应注视_________________________,若用酚酞作指示剂达到滴定终点颜色变化是______________________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________molL-1,烧碱样品的纯度是___________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____________。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果____________。
